En syre-base (proton overføring) reaksjon
For vårt første eksempel på en kjemisk reaksjon, la oss se på en svært enkel reaksjon som oppstår mellom hydroxide ion og saltsyre:
HCl+OH^- \Rightarrow H_20+Cl^-
Dette er en syre-base-reaksjon: en proton er overført fra HCl, syre, for å hydroxide, basen. Produktet er vann (konjugert syre av hydroxide) og klorid ion (konjugert base av HCl)., Du har utvilsomt sett denne reaksjonen før i generell kjemi. Til tross for sin enkelhet (og til tross for at reaktantene og produktene er uorganisk snarere enn organisk), denne reaksjonen gjør det mulig for oss å vurdere for første gang mange av de grunnleggende ideer i organisk kjemi som vi skal utforske i ulike sammenhenger i denne teksten.
– Tasten for å forstå akkurat om noen reaksjon mekanismen er begrepet electron tetthet, og hvordan det er koblet til electron-bevegelsen (bond-breaking og bond-forming) som oppstår i en reaksjon., Den hydroxide ion – spesifikt, electronegative oksygen atom i hydroxide ion – har høy electron tetthet på grunn av negativ ladning og polaritet av hydrogen-oksygen bond. Den hydroxide oksygen er electron-rik.

hydrogenatom i HCl, på den andre siden, har lav electron tetthet: det er electron-fattige. Som du kanskje forventer, noe som er electron-rik er tiltrukket av noe som er electron-fattige., Som hydroksid og HCl flytte nærmere hverandre, en enslig par av elektroner på elektron-rik hydroxide oksygen er tiltrukket av elektron-dårlig proton av HCl, og elektron-bevegelsen skjer mot proton. De to elektroner i hydrogen-klor sigma bond er frastøtt av dette nærmer seg hydroxide electron tetthet, og kan derfor bevege seg enda lenger bort fra proton og mot klor kjernen., Konsekvensen av alt dette electron bevegelse er at hydrogen-klor bånd er brutt, som de to elektroner fra at bond helt bryte fri fra 1s orbital av hydrogen og bli en enslig par i 3p orbital av en klorid anion.
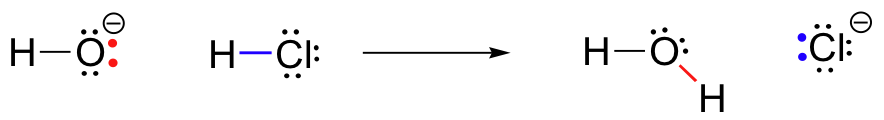
Samtidig for at hydrogen-klor bond er å bryte, en ny sigma bond-former mellom hydrogen og oksygen, som inneholder de to elektroner som tidligere var en enslig par på hydroxide. Resultatet av denne bindingen dannelse er, selvfølgelig, et molekyl vann.
Tidligere (avsnitt 6.1.,), vi så hvordan buet pilene ble brukt til å skildre electron bevegelse som oppstår i kjemiske reaksjoner, der obligasjonene er brutt og nye obligasjoner er dannet. HCl + OH– reaksjon, for eksempel, er avbildet ved å tegne to bøyde piler.
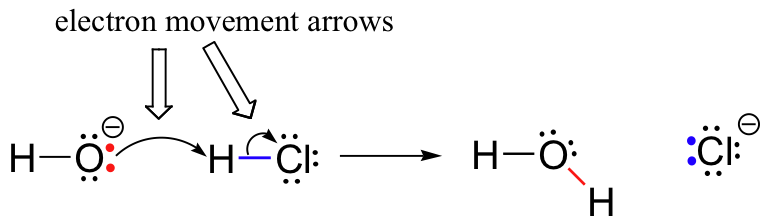
Den første pilen utspring på en av lone par på hydroxide oksygen og poeng til ‘H’ – symbolet i hydrogen bromide molekyl, for å illustrere den «angrep» av oksygen enslig par og påfølgende dannelse av nye hydrogen-oksygen bond., Den andre buet pil utspring på hydrogen-brom bond og poeng til «Br’ – symbol, noe som indikerer at denne bindingen er å bryte – de to elektroner er ‘leaving’ og bli en enslig par på bromide ion.
Det er svært viktig å legge vekt på dette punktet at disse buede, to-velprydt pilene alltid representere bevegelse av to elektroner. De fleste av denne boken vil være viet til beskrivelse av reaksjonsmekanismer involverer to-elektron bevegelse, så disse full-ledet pilene vil bli veldig kjent.,

I andre semester, imidlertid, vil vi se på radikal reaksjonsmekanismer, der ett-elektron bevegelse oppstår. For disse prosessene, en buet, single-velprydt («fish-hook’) pil vil bli brukt.
Trening
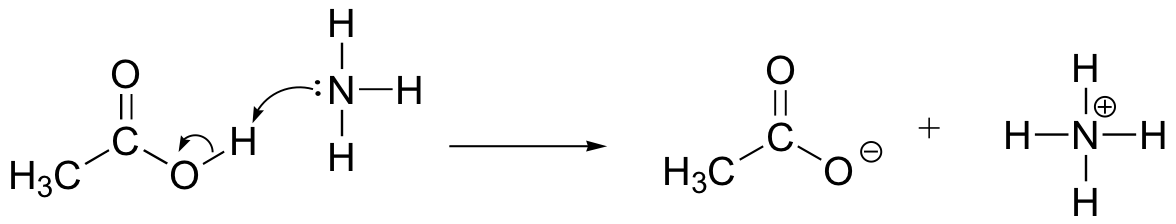
Draw electron movement-pilene for å illustrere syre-base reaksjon mellom eddiksyre, CH3COOH, og ammoniakk, NH3. Tegne ut hele Lewis strukturer av reaktanter og produkter.