Innledning
Den forståelse og forvaltning av V/Q relasjoner representerer acornerstone av intensivavdeling (ICU) pasientbehandling. TheV/Q forhold (Fig. 1) kan sees på som et spektrum betweendeadspace (uendelig V/Q) og shunt (null V/Q).
Når pulmonarycapillary blod er utsatt for en alveolar partialtrykket ofoxygen (PAO2), oksygen molekyler flytte inn theplasma som oppløst O2 og fortsette å utøve en partialpressure.,
de Fleste av disse oksygen molekyler umiddelbart kombinere withhemoglobin og inn i en tilstand der de ikke lenger direkte exerta partialtrykket. Denne prosessen fortsetter inntil en delvis pressuregradient mellom alveolus, og en plasma-ikke lenger eksisterer, atwhich punkt hemoglobin er maksimalt mettet for bloodPO2.
Selv om oppløst oksygen i plasmarepresents bare 1,5% til 3 % av den totale mengden oksygen i blodet, thePO2 verdi er viktig fordi det avgjør drivingforce for oksygen bevegelse inn og ut av blodet.,
Perfekt bloodgas exchange ville kreve hver alveolus å være ventilatedperfectly og alt blodet ut fra høyre hjertekammer totraverse funksjonell pulmonal kapillærer. I tillegg,diffusjon over alveolar/kapillær membran ville ha til å beunimpeded.
Fordi alle blodet går fra høyre hjertekammer til venstre ventrikkel ville nå perfekt likevekt med alveolargas, alveolar PO2 (PAO2) andthe arteriell PO2 (PaO2) ville beidentical.
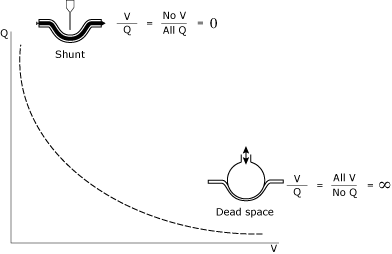
FIG. 1., Den matematiske og konseptuell illustrasjon av shunt og deadspace.
Som vist i Fig. 2, oksygenering i normale lunger maydiffer fra den ideelle situasjonen fordi fordelingen av perfusionis ujevn.
Relativt mer blodtilførsel skjer i thegravity-avhengige områder, og noen venøs drenering (fra thebronchial, pleural og Thebesian venene) som tømmer direkte inn theleft side av hjertet, og dermed omgå (shunting) den normaloxygenation mekanisme .,
på Grunn av dette, noen blod inn theleft ventrikkel med et lavere innhold av oksygen enn bloodexchanging med en ideell alveolus. Figur 3 representerer theresultant lavere PaO2 nivå sammenlignet med thecalculated ideell oksygen spenning.
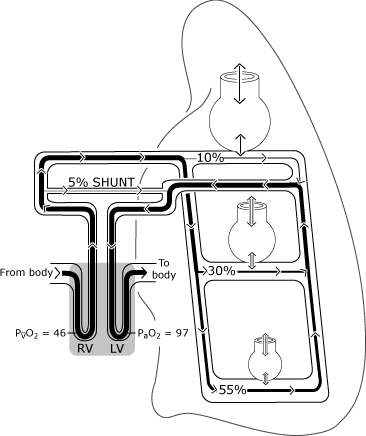
FIG. 2. Normal lunge har ufullkommen distribusjon av ventilasjon og perfusjon det er først og fremst bestemt av tyngdekraften. Illustrasjonen forutsetter en oppreist holdning, slik at lunge baser er i gravitasjon-avhengige stilling., Den ikke-tyngdekraft-avhengige alveolene er større, men får mindre gass exchange (ventilasjon) enn tyngdekraften avhengige av alveoler. Fordeling av perfusjon er først og fremst styrt av tyngdekraften med ca 55 % strømmer til tyngdekraften-avhengige områder, 30 % til mid-lunge områder og 10 % til ikke-tyngdekraft-avhengige lunge områder. PaO2 og PvO2 er uttrykt i mmHg (kPa = mmHg × 0.133); RV = høyre ventrikkel; LV = venstre ventrikkel. Gjengitt med tillatelse fra Elsevier Health Sciences.
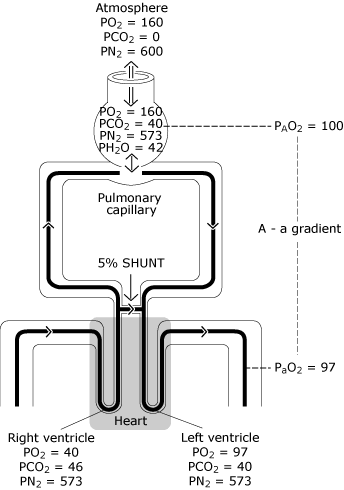
FIG. 3., Normal lunge har ufullkommen distribusjon av ventilasjon, ufullkomne distribusjon av perfusjon og noen minimal grad av intrapulmonary shunting. Resultatet er en nedgang i PO2 fra beregnet ideell alveolar verdi (PAO2) til målt systemisk arterielt blod verdi (PaO2). Dette PO2 forskjellen er kjent som «alveolar-til-arteriell oksygen spenning fargeovergang» . PO2 = oksygen spenning uttrykt i mmHg; PCO2 = karbondioksid spenning uttrykt i mmHg; PN2 = nitrogen spenning uttrykt i mmHg; PH2O = vanndamp spenning uttrykt i mmHg. (kPa = mmHg × 0.133)., Gjengitt med tillatelse fra Elsevier Health Sciences.
Shunt og hypoxemia
Anatomisk shunting er definert som blod som går fra høyre sideto venstre side av hjertet uten å komme igjennom pulmonarycapillaries. Kapillær shunting er definert som blod som går suge høyre side av hjertet til venstre side av hjertet viapulmonary kapillærer som er tilstøtende til unventilated alveoler.
Begge tilfeller tillater blodet å gå inn i det venstre-sidig sirkulasjon withoutan økning i innhold av oksygen., Dette er referert til som null V/Q, ortrue shunting, fordi blodet har ikke hatt noen mulighet for gasexchange med funksjonell alveoler.
Et eksempel på shunting i theclinical innstillingen er gass exchange avvik sett inpneumonia ved utgivelsen av endotoksin som fører til mobil edemaand vasoconstriction .
Shunting og hypoxemia er ikke synonyme begreper, og heller ikke theyhave lineære relasjoner. Den hypoxemic effekten av eventuelle shunt willdepend ikke bare på størrelsen av shunt, men også på oxygenationstatus av venøse blodet som shunter(SVO2)., En liten shunt med en lowSVO2 kan ha dyptgripende hypoxemic virkninger,mens en stor shunt med en høy SvO2 willcause mindre betydelige hypoxemia.
Det kan være oppgitt utvetydig at når hypoxemia eksisterer, somedegree av shunting (intrapulmonary eller intracardiac) må bepresent, men effekten av shunt på thePaO2 avhenger i stor grad på cardiovascularfunction og metabolske rate. Arteriell hypoxemia er et resultat av lungfunction, kardiovaskulær funksjon og metabolisme.,
Vurdering av thelungs som en oxygenator er viktig i omsorgen for mange patientsrequiring hjerte-og støttende omsorg. Beregning ofintrapulmonary shunting representerer den beste tilgjengelige midler ofdelineating den grad pulmonal system bidrar tohypoxemia.
Intrapulmonary shunt
Som nevnt tidligere, intrapulmonary shunt er definert som thatportion av cardiac output inn på venstre side av heartwithout gjennomgår perfekt gassutveksling med helt functionalalveoli. Intrapulmonary shunt kan deles inn i threecomponents.,
- Anatomisk shunting har tidligere blitt beskrevet som blod som går inn i venstre side av hjertet uten å komme igjennom pulmonal kapillærer. I tillegg til normal anatomisk shunting fra bronkial, pleural og Thebesian årer, anatomisk shunting kan økes ved vaskulær lungesvulster og høyre-til-venstre-intracardiac shunter.
- Kapillær shunting er forårsaket når blodet går gjennom pulmonal kapillærer, men ikke la med alveolar gass på grunn av patologisk prosesser som atelectasis, lungebetennelse og akutt lungeskade skade.,
- Venøs tilsetningsstoff oppstår når blodet equilibrates med en alveolar PO2 som er mindre enn ideell som i situasjoner med lavt V/Q . Fordi venøs tilsetningsstoff er ikke sant shunt, er dette noen ganger fører til forvirring. Summen av anatomiske og kapillær shunter er mest vanlig kalt zero V/Q eller sann shunt. Venøs tilsetningsstoff er ofte referert til som lave V/Q eller «shunt effekt». Fysiologisk shunt i normal eller ikke-syke lungene er en måling av normal intrapulmonary shunt. I innstillingen av lunge patologi, fysiologisk shunt først og fremst representerer alvorlighetsgraden av sykdommen staten.,
shunt ligningen
ligningen brukes til å beregne shunt del ofthe minuttvolum forutsetter at ikke-shunting gass perfectlyoxygenates ved å utveksle informasjon med perfekt alveolar gass.
Selv om theintrapulmonary shunt konseptet reflekterer ikke regionalrelationships, som gjør ventilasjon perfusjon konseptet, er det doesreflect den grad lunge avviker fra den ideelle som anoxygenator av pulmonal blod.
Det er denne kvantitative evne tolook på lungene som en oxygenator som gjør dette measurementunique og verdifulle i klinisk setting., Denne anmeldelsen bruker theterm fysiologisk shunt i referanse til intrapulmonary shuntcalculated med pasienten å puste mindre enn 100 % oksygen.
avledning av shunt ligningen kommer fra konseptene ofFick. I 1870, introduserte han den klassiske forhold som thequantity av oksygen tilgjengelig for vev utnyttelse per enhet timeincludes den arterielt oksygeninnhold (CaO2)multiplisert med mengden av arterielt blod presentert for thetissues per tidsenhet (dvs., minuttvolum, Qt).,
Ligning 1:
Oksygen tilgjengelig =(Qt)(CaO2)
Oksygen tilbake til lungene inneholder minuttvolum(Qt) multiplisert med blandet venøs innhold av oksygen(CVO2).
Ligning 2:
Oksygen returnert =(Qt)(CvO2)
Oksygen forbruk per tidsenhet (VO2) bør reflectthe oksygen som er hentet ut fra blodet i at timeperiod.,
Ligning 3:
VO2 = (Qt)(CaO2)– (Qt)(CvO2)
Ligning 3 kan deretter bli omskrevet så hva er classicallydescribed som Fick Ligningen.
Ligning 4:
VO2 = Qt(CaO2 –CvO2)
Omorganisert algebraically, Ligning 4 kan uttrykkes som afunction av minuttvolum.,
Ligning 5:
Qt = VO2/(CaO2 –CvO2)(10)
for Å uttrykke minuttvolum i liter per minutt oxygendifference må være
multiplisert med en faktor på 10.
To andre ligningene som man må bli kjent er theclassic shunt likningen (Likning 6), som beskriver ratiobetween shunted minuttvolum og total minuttvolum(QS/Qt). Det er målt med patientbreathing 100 % oksygen.,
Ligning 6:
QS/Qt = (CcO2 –CaO2)/(CcO2 –CvO2)
Den fysiologiske shunt ligning (QSP/Qt) isanother måte å uttrykke Ligning 6 når målt med patientbreathing mindre enn 100 % oksygen og noen venøs tilsetningsstoff eksisterer.Derav fysiologisk shunt ligningen er:
Ligning 7:
QSP/Qt = (CcO2 –CaO2)/ (CcO2 –CvO2)
QSP/Qt har fordelen av beingderived som et forholdstall, slik at ingen absolutte mål på minuttvolum isrequired., I dette skjemaet, vil ligningen viser klart at asthe shunted minuttvolum nærmer seg null, den arterielle oxygencontent må nærme seg den teoretiske slutten pulmonal capillaryoxygen innhold.
så lenge Som noen del av cardiac output doesnot perfekt utveksling med perfekt alveoler, den arterielle oxygencontent må være mindre enn ideell slutten pulmonal kapillær oxygencontent.
implikasjonene av fysiologisk shunt ligningen kan beconceptualized ved å vurdere innhold av oksygen vilkår(CcO2, CaO2,CvO2) som enheter som kan helles i acontainer (Fig. 4)., Visse faktorer, slik som hemoglobinconcentration, kan påvirke alle tre nivåer.
Den mest importantclinical variabel som påvirker CcO2 isFiO2, mens både totalt minuttvolum andoxygen forbruk påvirker CvO2. Endringer i fysiologiske shunt påvirke CaO2.
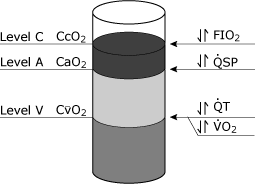
FIG. 4. Skjematisk representasjon av blod oksygen nivåer som kan teoretisk sett bli innhentet fra tre separate områder i det kardiovaskulære systemet. Nivå C representerer slutten pulmonal kapillært blod oksygen innhold (CcO2)., Nivå A representerer den systemiske arterielt blod oksygen innhold (CaO2), og Nivå V representerer blandet venøs (lungearterie) blod oksygen innhold (CvO2). De mest vanlige kliniske variabler som spesifikt påvirker disse ulike nivåer er vist: Nivå C er mest påvirket av endringer i FIO2 (inspirert oksygen brøkdel), Nivå A er spesielt påvirket av endringer i fysiologiske shunt (QSP), Nivå V er spesielt påvirket av både den totale minuttvolum (QT) og frekvensen av oksygen forbruk (VO2). Gjengitt med tillatelse fra Elsevier Health Sciences.,
telleren av shunt ligningen er representert bydifferences i CcO2 andCaO2. Nevneren i ligning isrepresented av forskjeller i CcO2 andCvO2.
Endringer av ulik størrelse amongthese tre nivåer vil endre forholdet, noe som tilsvarer tochanges i fysiologisk shunt beregning.
Hvis en pasient developsfulminant høyre-, midtre – og nedre-lapp konsolidering, thearterial og lungepulsåren blod gass målinger vil avsløre aclinical bilde som vist i Fig. 5.,
Den arterielle oxygentension og innhold er betydelig redusert på grunn av en largeintrapulmonary shunt. Hvis minuttvolum forblir uendret andthe arteriell-blandet venøs oksygen forskjellen ikke endre, thenthe CvO2 må også reduseres.
på Grunn av thechange av ulik størrelse, den fysiologiske shunt vil greatlyincrease sekundært til hypoxemia.
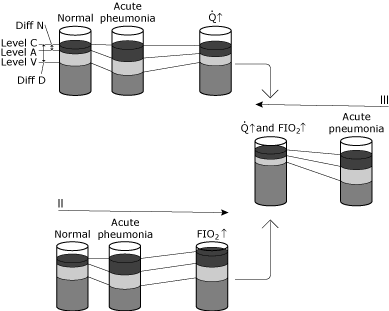
FIG. 5. Skjematisk fremstilling av endringer i blodet oksygen nivåer under ulike forhold., Formålet med denne illustrasjonen er å forklare forskjellen mellom fysiologisk shunting og hypoxemic effekten av fysiologisk shunting. I, II, og III illustrere endringer i en normal person som kontrakter lungebetennelse som fører til en betydelig økning i intrapulmonary shunting uten kompenserende fysiologisk endring., Status fra normal til akutt lungebetennelse viser: ingen endring i Nivå C fordi ventilasjon og FIO2 er uendret, en bestemt fall i Nivået på grunn av økt shunting opprettet av lungebetennelse, og en nedgang i Nivå V på grunn AV innhold forskjellen er uendret (minuttvolum og oksygen forbruk uendret). Siden Diff N har økt i større grad enn Diff D, beregnet shunt øker. Tilstand 1 viser en økt minuttvolum (Q↑) i respons til den akutte hypoxemia. Nivå C forblir uendret siden verken ventilasjon eller FIO2 har blitt endret., AV innhold forskjellen har falt fordi minuttvolum har økt, mens oksygen forbruk forblir uendret. Økningen i Nivå V resulterer i en ny dynamisk likevekt i hvilket Nivå En er også økt. Vær oppmerksom på at forholdet mellom Diff N og Diff D er bare litt endret. Dermed, Nivå A (og dermed PaO2) har økt med liten endring i beregnet shunt. I dette tilfellet, kompensasjon for hypoxemia er kretsløpssystem; den intrapulmonary shunt har ikke endret seg. Tilstand II viser en økt inspirert oksygen konsentrasjon (FIO2↑)., Nivå C øker, mens AV innhold forskjellen forblir uendret (minuttvolum og oksygen forbruk uendret). En ny dynamisk likevekt resultater i Nivå A (og dermed PaO2 øke). Forholdet mellom Diff N og Diff D er bare litt endret. Nivå A (og derfor PaO2) har økt med liten endring i beregnet shunt. I dette tilfellet, kompensasjon for hypoxemia er via oksygen terapi; den intrapulmonary shunt er i hovedsak uendret. Tilstand III viser både blodsirkulasjon og inspirert oksygen konsentrasjon endringer (Q↑ og FIO2↑)., Merk den dype økning i Nivå A (og derfor PaO2) med liten endring i den Va N/Diff D. Gjengitt med tillatelse fra Elsevier Health Sciences.
Alvorlig hypoxemia vil vanligvis føre til en økning i cardiacoutput. Dette resulterer i en reduksjon i den arterielle-venøs oxygencontent forskjellen som reflekteres av en økning inCvO2.
En ny likevekt vil resultere i anincrease av CaO2 uten en endring i forholdet(QSP/Qt). Den arterielle PO2improves sterkt, uten en betydelig endring i fysiologiske shuntsecondary, på grunn av bedret blodsirkulasjon.,
Hvis forutsetningen er gjort som supplerende oksygen isadministered til denne pasienten mens minuttvolum remainsunchanged, CcO2 er økt sekundært til anincreased alveolar PO2. Siden den fysiologiske shuntremains det samme, og den arterielle-venøs innhold av oksygen differenceremains det samme, en ny likevekt resultater inCaO2 og CvO2increasing.
til Slutt, forholdet er endret for å skildre en pasient withoxygen terapi og en økning i minuttvolum.CaO2 øker fordi bothCcO2 og CvO2 øke.Hypoxemia forbedrer mens forholdet (QSP/QT)forblir uendret.,
Den fysiologiske shunt beregning kan sikkert reflektere thedegree av gass exchange knyttet til intrapulmonary sykdom orintracardiac shunting uavhengig av andre faktorer som kan alsoplay en rolle.
Fordi flere årsaker til hypoxemia er frequentlyencountered i kritisk syke, evnen til å kvantifisere thedegree av intrapulmonary pathophysiology er en ekstremt importanttool.
Hvordan å finne ut shunt
intrapulmonary shunt kan måles bare whenboth arteriell og pulmonal arteriell blodprøver er availableand den FIO2 er konstant., Katetre insertedinto sentral venøs sirkulasjon som ligger like over thesuperior vena cava-høyre atrial krysset er i stor grad mangelfull forshunt bestemmelser fordi blodet trekkes fra denne posisjonen willnot inneholder betydelig mindre mettede blod fra coronarysinus eller dårligere vena cava.
blodprøver tatt fra rightatrium utstilling betydelig innhold av oksygen variasjon fordi ofchanneling av blodstrøm og bevegelse av kateterspissen. Cathetertips i høyre hjertekammer kan føre til ventrikulære ectopy og yieldvariable innhold av oksygen prøver., Blandet venøs prøvene er obtainedfrom lungearterien kateteret.
Normale verdier er en bety partialpressure av O2 i blandet venøs blod 40 mmHg(SVO2 75 %).
Hvis du på alle mulige pasienten bør ikke bli stimulert ordisturbed i flere minutter før prøvetaking. Forsiktighet bør være takento unngå luftveiene avsug og andre prosedyrer under denne timeperiod. Det arterielle og blandet venøs prøve skal være drawnsimultaneously. Forsiktighet må utvises for å unngå utvalgsfeil,spesielt fra lungepulsåren kateteret.,
Når blodet samplesare trukket fra lungepulsåren, må prøven være drawnslowly fordi rask aspirasjon kan resultere i pulmonal capillaryblood blir blandet med lungearterie blodet, forårsaker dramaticincreases i innhold av oksygen .
Rask flyt av intravenøs fluidsvia en sentral venøs kateteret eller mer proksimale PA kateter portscan forurense blod trukket fra den distale port av PA catheterand føre til feilaktige hemoglobin bestemmelser og oksygen contentcalculations.
CaO2 og CvO2values er beregnet., Det bør ikke være mer enn 1 g/dLdifference mellom hemoglobin innhold av de to prøvene. Anaverage av de to er anbefalt for beregningene hvis thedifference er mer enn 0,5 g/dL.
Det er anbefalt thatcarboxyhemoglobin måles eller antatt å være 1,5 prosent . TheCcO2 verdi er deretter beregnet ved hjelp av theaverage eller arterielt hemoglobin innhold og forutsatt at partialpressure av O2 i kapillær seng er lik thePaO2. Hvis PaO2 isgreater enn 150 mmHg, alle tilgjengelige hemoglobin er antatt å besaturated.
True shunt er refraktære til oksygenbehandling., Dette resulterer i whatis kalt «ildfast hypoxemia». Fordi ildfast hypoxemia doesnot svare på oksygen terapi, andre midler bør søkes toimprove arteriell oksygenering. Disse kan omfatte behandling av theunderlying patologi, bruk av Positive Enden ExpiratoryPressure (PEEP) terapi eller økende innhold av oksygen til maintainacceptable oksygentilførsel.
De mest vanlige årsakene til refractoryhypoxemia er delt inn i hjerte-og lunge., Den mest commonpulmonary årsaker er konsolidert lungebetennelse, atelectasis,neoplasm, eller akutt respiratorisk distress syndrom/akutt lunginjury.
Shunt og PEEP
Siden true shunt er ikke oksygen responsiv, positiveend expiratory pressure eller PEEP terapi kan brukes til å thediseased lungene for å bidra til å redusere QSP/QT. Amongthe fysiologiske responser sett med PEEP er bedret oksygenering,økt funksjonell residual kapasitet, bedre lunge complianceand en nedgang i shunting.,
nedgangen i shunting sett med PEEPis mest klassisk knyttet til alveolar rekruttering eller anincrease i funksjonell residual kapasitet sekundært til inflationof tidligere kollapset alveoler .
Gattinoni har describedusing computertomografi de regionale gass distribusjon i tissuesduring den titrering av PEEP . Disse studier har bekreftet theclassic vendepunkt i gass/vev kurve, som isconsistent med alveolar rekruttering .
svar av PEEPtitration varierer ikke bare med den type lunge patologi men alsowith regionen lunge studert., Mer avhengige lunge regionsundergo større grad av alveolar rekruttering mens lessdependent lunge regioner har en tendens til å oppleve større økning inalveolar volum uten rekruttering og regioner av lunge at arenon-responsiv til PEEP er jevnt fordelt gjennom lungene.
Andre metoder for å bedre oksygenering inkluderer er utsatt for posisjonering,noe som øker homogenitet av intrapulmonary prosessen andimproves ventilasjon .