Eine Säure – Base – Reaktion (Protonen-Transfer)
Für unser erstes Beispiel chemischer Reaktivität betrachten wir eine sehr einfache Reaktion, die zwischen Hydroxidion und Salzsäure auftritt:
HCl+OH^ – \Rightarrow H_20+Cl^ –
Diese ist eine Säure-Basen-Reaktion: Ein Proton wird von HCl, der Säure, auf Hydroxid, die Base, übertragen. Das Produkt ist Wasser (die Konjugatsäure von Hydroxid) und Chloridion (die Konjugatbasis von HCl)., Sie haben diese Reaktion zweifellos schon einmal in der allgemeinen Chemie gesehen. Trotz seiner Einfachheit (und trotz der Tatsache, dass die Reaktanten und Produkte eher anorganisch als organisch sind) können wir mit dieser Reaktion zum ersten Mal viele der grundlegenden Ideen der organischen Chemie berücksichtigen, die wir in diesem Text in verschiedenen Kontexten untersuchen werden.
Schlüssel zum Verständnis fast jeder Reaktionsmechanismus ist das Konzept der Elektronendichte, und wie es mit der Elektronenbewegung verbunden ist (Bond-breaking und Bond-forming), die in einer Reaktion auftritt., Das Hydroxidion-insbesondere das elektronegative Sauerstoffatom im Hydroxidion-weist aufgrund der negativen Ladung und der Polarität der Wasserstoff-Sauerstoff-Bindung eine hohe Elektronendichte auf. Der Hydroxid-Sauerstoff ist elektronenreich.

Das Wasserstoffatom in HCl hingegen hat eine geringe Elektronendichte: Es ist elektronenarm. Wie Sie vielleicht erwarten, wird etwas, das elektronenreich ist, von etwas angezogen, das elektronenarm ist., Wenn sich Hydroxid und HCl näher zueinander bewegen, wird ein einzelnes Elektronenpaar auf dem elektronenreichen Hydroxidsauerstoff von dem elektronenarmen Proton von HCl angezogen, und die Elektronenbewegung erfolgt in Richtung des Protons. Die beiden Elektronen in der Wasserstoff-Chlor-Sigma-Bindung werden durch diese annähernde Hydroxidelektronendichte abgestoßen und bewegen sich daher noch weiter weg vom Proton und zum Chlorkern., Die Folge all dieser Elektronenbewegung ist, dass die Wasserstoff-Chlor-Bindung unterbrochen wird, da sich die beiden Elektronen dieser Bindung vollständig aus dem 1s-Orbital des Wasserstoffs lösen und zu einem einsamen Paar im 3p-Orbital eines Chloridanions werden.
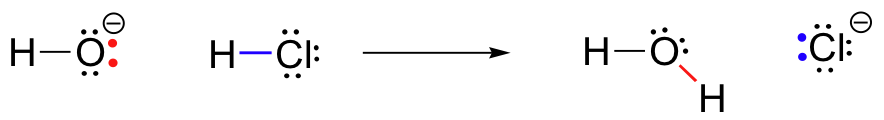
Zur gleichen Zeit, in der die Wasserstoff-Chlor-Bindung bricht, bildet sich eine neue Sigma-Bindung zwischen Wasserstoff und Sauerstoff, die die beiden Elektronen enthält, die zuvor ein einsames Paar auf Hydroxid waren. Das Ergebnis dieser Bindungsbildung ist natürlich ein Wassermolekül.
Zuvor (Abschnitt 6.1.,), wir sahen, wie die gekrümmten Pfeile wurden verwendet, um darzustellen, Elektron Bewegung, tritt bei chemischen Reaktionen, in denen Bindungen gebrochen und neue Bindungen werden gebildet. Die HCl + OH– Reaktion wird beispielsweise durch Zeichnen von zwei gekrümmten Pfeilen dargestellt.
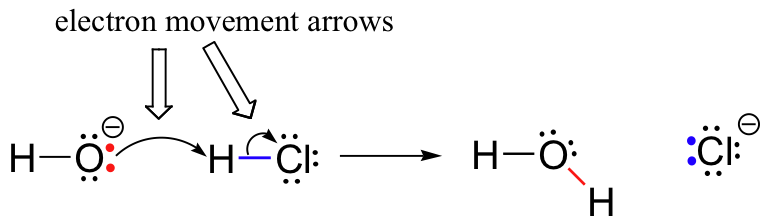
Der erste Pfeil stammt von einem der einsamen Paare auf dem Hydroxidsauerstoff und zeigt auf das Symbol ‚H‘ im Bromwasserstoffmolekül, das den „Angriff“ des Sauerstoff-einsamen Paares und die anschließende Bildung der neuen Wasserstoff-Sauerstoff-Bindung veranschaulicht., Der zweite gekrümmte Pfeil stammt aus der Wasserstoff-Brom-Bindung und zeigt auf das Symbol „Br“, was darauf hinweist, dass diese Bindung bricht – die beiden Elektronen „verlassen“ und werden zu einem einsamen Paar auf Bromidion.
Es ist an dieser Stelle sehr wichtig zu betonen, dass diese gekrümmten, zweistabigen Pfeile immer die Bewegung von zwei Elektronen darstellen. Der größte Teil dieses Buches wird der Beschreibung von Reaktionsmechanismen mit Zwei-Elektronen-Bewegung gewidmet sein, so dass diese vollköpfigen Pfeile sehr vertraut werden.,

Im zweiten Semester werden wir uns jedoch mit radikalen Reaktionsmechanismen befassen, bei denen Einzelelektronenbewegungen auftreten. Für diese Prozesse wird ein gekrümmter Pfeil mit einem Stacheldraht („Angelhaken“) verwendet.
<
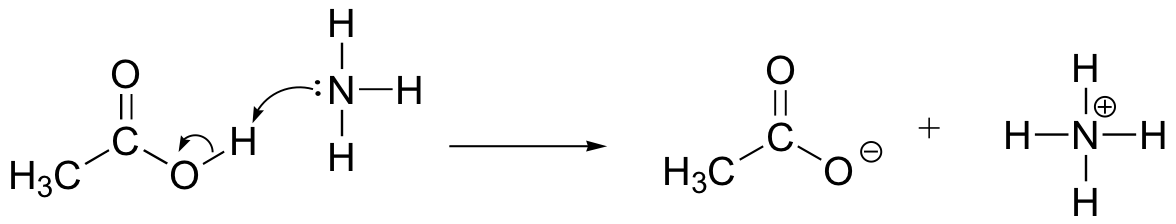
Zeichnen Sie Elektronenbewegungspfeile, um die Säure-Basen-Reaktion zwischen Essigsäure, CH3COOH und Ammoniak, NH3, zu veranschaulichen. Zeichnen Sie die vollständigen strukturellen Strukturen von Reaktanten und Produkten auf.