Rutherford at Manchester, 1907-1919
Ernest Rutherford odkrył jądro atomu w 1911 roku. Czytamy o tym w podręcznikach i w popularnych pismach. Ale co oznacza to stwierdzenie? Odkrycie geograficzne zwykle oznacza, że widzi się miejsce po raz pierwszy. Ale czy odkrycie może być takie samo dla królestwa ukrytego przed wzrokiem? Nie można zobaczyć atomu w tym sensie., Sugeruje to, że być może historia odkrycia jądra była bardziej skomplikowana. Historia, która rozwinęła się w laboratorium Rutherforda na Uniwersytecie w Manchesterze, obracała się wokół prawdziwych ludzi. Wiązało się to z frustracjami i triumfami. Wiązało się to z ciężką pracą, zakłopotaniem i inspiracją.
 kiedy Rutherford został profesorem w Manchesterze w 1907 roku, znalazł nowoczesne laboratoria zarówno do nauczania, jak i badań. Za namową swojego poprzednika, Arthura Schustera, zebrano ponad 40 000 funtów na sfinansowanie programu fizyki. Dla porównania, hojna pensja Rutherforda wynosiła £1,600 / rok., Kredyt: From the book: the physical laboratories of the University of Manchester: a record of 25 years ' work by the University of Manchester, Manchester: at the University Press, 1906. AIP Emilio Segrè Visual Archives, Brittle Books Collection.
kiedy Rutherford został profesorem w Manchesterze w 1907 roku, znalazł nowoczesne laboratoria zarówno do nauczania, jak i badań. Za namową swojego poprzednika, Arthura Schustera, zebrano ponad 40 000 funtów na sfinansowanie programu fizyki. Dla porównania, hojna pensja Rutherforda wynosiła £1,600 / rok., Kredyt: From the book: the physical laboratories of the University of Manchester: a record of 25 years ' work by the University of Manchester, Manchester: at the University Press, 1906. AIP Emilio Segrè Visual Archives, Brittle Books Collection.
Rutherford przybył do Manchesteru latem 1907 roku, na kilka miesięcy przed rozpoczęciem kadencji Uniwersytetu. Został mianowany profesorem fizyki w Langworthy, następcą Arthura Schustera (1851-1934), który przeszedł na emeryturę w wieku 56 lat, aby zatrudnić Rutherforda. Schuster zbudował nowoczesny budynek fizyki, zatrudnił dr Hansa Geigera., (1882-1945) ze względu na swoje umiejętności eksperymentalne i obdarzył nową pozycję w fizyce matematycznej, aby zaokrąglić pełny program fizyki. Rutherford wszedł do centrum świata fizyki. Badacze przybyli do niego przez tuzin.
Nie skończył z zagadkami rodzin rozpadów toru, Radu itp., ale wiele z tych prac przekazywał Boltwoodowi, Hahnowi i Soddy ' emu. Boltwood i Hahn pracowali razem z Rutherfordem w Manchesterze, Boltwood w latach 1909-1910 i Hahn w latach 1907-1908., Rutherford stopniowo skupiał swoją uwagę bardziej na samych promieniach α (Alfa), β (beta) i γ (gamma) oraz na tym, co mogą ujawnić o atomie. To znaczy, że zostawiał radio-chemię innym i zwracał się do fizyki.
 Rutherford zawsze skupiał wokół siebie grupę jasnych młodych badaczy. Na zdjęciu grupowym z 1910 roku są Ernest Marsden i Hans Geiger. Z przodu i na środku znajdują się profesorowie Schuster i Rutherford, A Z Tyłu William Kay, utalentowany i pomocny steward laboratorium. Autor: J. B. Birks, ed.,, Rutherford at Manchester (London: Heywood & , 1962), opposite s. 38.
Rutherford zawsze skupiał wokół siebie grupę jasnych młodych badaczy. Na zdjęciu grupowym z 1910 roku są Ernest Marsden i Hans Geiger. Z przodu i na środku znajdują się profesorowie Schuster i Rutherford, A Z Tyłu William Kay, utalentowany i pomocny steward laboratorium. Autor: J. B. Birks, ed.,, Rutherford at Manchester (London: Heywood & , 1962), opposite s. 38.
do pierwszej drużyny Rutherforda w Manchesterze należeli Geiger i William Kay (1879-1961), młodszy asystent laboratoryjny od 1894 roku. Rutherford w 1908 roku awansował Kay ' a na stewarda laboratoryjnego, który zarządzał sprzętem laboratoryjnym i pomagał mu w jego badaniach. W 1957 roku Kay przypomniał sobie swoją młodość z Rutherfordem w wywiadzie. Język jest osobliwy, ale opis jest zbliżony do podejścia Rutherforda., Pytającym był Samuel Devons (1914-2006), który był jednym z ostatnich studentów Rutherforda w latach 30.
 Hans Geiger był głównym partnerem Rutherforda w badaniach nad promieniami alfa w latach 1907-1913. Wspólnie opracowali kilka sposobów wykrywania promieni Alfa. Udowodnili, że promienie alfa są podwójnie zjonizowanymi jądrami Helu. Ok. 1908. Źródło: AIP Emilio Segre Visual Archives, Physics Today Collection.
Hans Geiger był głównym partnerem Rutherforda w badaniach nad promieniami alfa w latach 1907-1913. Wspólnie opracowali kilka sposobów wykrywania promieni Alfa. Udowodnili, że promienie alfa są podwójnie zjonizowanymi jądrami Helu. Ok. 1908. Źródło: AIP Emilio Segre Visual Archives, Physics Today Collection.
Rutherford i Hans Geiger ściśle współpracowali w latach 1907 i 1908 nad wykrywaniem i pomiarem cząstek α., Gdyby użyli cząstek α do badania atomu, najpierw dowiedzieli się więcej o tych cząstkach i ich zachowaniu. Rutherford próbował i nie udało się Mcgillowi policzyć cząstki α.
rok później w Manchesterze udało mu się wraz z Geigerem wykonać dwie metody obserwacji cząstek α. Pierwsza metoda polegała na scyntylacjach wzbudzonych przez cząstki α na cienkiej warstwie siarczku cynku. Obserwowali je pod mikroskopem i liczyli scyntylacje pod różnymi kątami rozproszenia., Opracowali również „elektrometr”, który mógłby zademonstrować Przejście pojedynczej cząstki α do dużej publiczności. Instrument, który przekształcił się w” licznik Geigera”, miał częściowo opróżniony metalowy cylinder z drutem w środku. Przyłożyli napięcie między cylindrem a przewodem wystarczająco wysokie, aby iskrzyć. Dopuścili cząstki α przez cienkie okno Miki, gdzie cząstki te zderzyły się z gazami, wytwarzając jony gazu. Następnie zderzyły się one z innymi cząsteczkami i wytworzyły więcej jonów i tak dalej., Każda cząstka α wytwarzała kaskadę jonów, która częściowo wyładowywała cylinder i wskazywała Przejście cząstki α. Geiger i Rutherford opublikowali kilka artykułów w 1908 i 1909 na temat tych metod i ich stosowania.
Rutherford napisał 11 lipca 1908 do Henry ' ego Bumsteada (1870-1920), amerykańskiego fizyka:
Geiger jest dobrym człowiekiem i pracuje jak niewolnik. Nigdy nie znalazłbym czasu na mękę, zanim wszystko pójdzie w dobrym stylu. W końcu wszystko poszło dobrze, ale rozpraszanie to diabeł. Nasza rura działała jak urok i mogliśmy łatwo uzyskać rzut 50 mm., dla każdej cząstki. … Geiger jest demonem zajmującym się liczeniem scyntylacji i może liczyć w odstępach czasu przez całą noc, nie zakłócając jego spokoju. Po dwóch minutach przeszedłem na emeryturę. (Cyt. za Ewą, s. 180.)
chociaż Rutherford podejrzewał już w 1906, że cząstki α są atomami helu pozbawionymi elektronów, zażądał wysokiego standardu dowodu. Jeden rodzaj eksperymentu nie wystarczył. Jeden rodzaj detektora nie wystarczył. Chciał więcej dowodów., W tym celu Rutherford chciał” dużych napięć ” i dużych elektromagnesów, aby przekierować cząstki α, ale ta metoda nie była jeszcze dojrzała. Steward William Kay przypomniał w wywiadzie z historii mówionej, że Rutherford w 1908 roku nalegał, aby silne pola elektryczne i magnetyczne były potrzebne do bezpośredniego pomiaru ładunku i masy cząstek α i β:
Kay powiedział, że Rutherford chciał dużego, chłodzonego wodą magnesu, ale „upuścił go jak gorący tort”, gdy dowiedział się o jego kosztach. Więc potrzebował nowej linii ataku. Nowa linia była bardzo prosta, procedura chemiczna zmieszana z fizyką., Do tej pracy Rutherford zwerbował Thomasa Roydsa( 1884-1955), który w 1906 roku uzyskał stopień doktora fizyki. Zebrali cząsteczki α w zamkniętej szklanej rurce, skompresowali je i przepuścili iskrę elektryczną. Badali emitowane światło w spektroskopie i stwierdzili, że jest identyczne z widmem helu. W ciągu kilku miesięcy Rutherford otrzymał Nagrodę Nobla w dziedzinie chemii „za badania nad rozpadem pierwiastków i chemią substancji radioaktywnych.,”(Nobel citation) Rutherford i Royds ustalili tożsamość i podstawowe właściwości cząstek α. Rutherford zwrócił następnie uwagę na wykorzystanie ich do badania atomu.
jesienią 1908 roku rozpoczęła się ważna seria badań. Geiger przepuszczał wiązki cząstek α przez złoto i inne metaliczne folie, wykorzystując nowe techniki detekcji do pomiaru stopnia rozproszenia tych wiązek przez atomy w foliach. Geiger uważał, że Ernest Marsden (1889-1970), 19-letni student fizyki z wyróżnieniem, był gotowy pomóc w tych eksperymentach i zaproponował go Rutherfordowi., Ponieważ Rutherford często popychał studentów trzeciego roku do badań, mówiąc, że jest to najlepszy sposób, aby dowiedzieć się o fizyce, chętnie zgodził się.
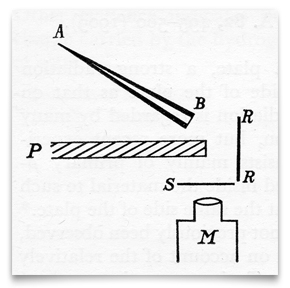 ten szkic, z artykułu Geigera I Marsdena z 1909 roku, pokazuje stożkową szklaną tubę pełną „emanacji Radu” (radonu), zamkniętą w punkcie B cienką taflą Miki. To było ich źródło cząstek alfa (α). S był sitem cynkowo-siarczkowym, który scyntylował się po uderzeniu przez cząstkę α. P był ekranem ołowianym, który blokował wszelkie cząstki α podróżujące bezpośrednio do ekranu siarczku cynku., RR była folią (lub foliami) różnych metali (w tym złota), które „dyfuzyjnie odbijały” padające cząstki α. Geiger and Marsden observed the resulting scintillations through an observing microscope, M. Credit: H. Geiger and E. Marsden, „On a Diffuse Reflection of the α-Particles,” Proceedings of the Royal Society, 1909, 82: 495-500.
ten szkic, z artykułu Geigera I Marsdena z 1909 roku, pokazuje stożkową szklaną tubę pełną „emanacji Radu” (radonu), zamkniętą w punkcie B cienką taflą Miki. To było ich źródło cząstek alfa (α). S był sitem cynkowo-siarczkowym, który scyntylował się po uderzeniu przez cząstkę α. P był ekranem ołowianym, który blokował wszelkie cząstki α podróżujące bezpośrednio do ekranu siarczku cynku., RR była folią (lub foliami) różnych metali (w tym złota), które „dyfuzyjnie odbijały” padające cząstki α. Geiger and Marsden observed the resulting scintillations through an observing microscope, M. Credit: H. Geiger and E. Marsden, „On a Diffuse Reflection of the α-Particles,” Proceedings of the Royal Society, 1909, 82: 495-500.
Geiger i Marsden zaczęli od dyspersji małokąt i próbowali różnych grubości folii, szukając matematycznych zależności między dyspersją a grubością folii lub liczbą atomów przemierzanych., Marsden przypomniał później, że Rutherford powiedział do niego podczas tych eksperymentów: „sprawdź, czy możesz uzyskać jakiś efekt cząstek alfa bezpośrednio odbijających się od powierzchni metalu.”(Related by Marsden in Birks, 1962, s. 8). Marsden wątpił, że Rutherford spodziewa się rozproszenia cząstek α, ale jak napisał Marsden
…było to jedno z tych „przeczuć”, że być może można zaobserwować jakiś efekt i że w każdym razie sąsiednie terytorium Ziemi Toma Tiddlera może zostać zbadane przez rekonesans., Rutherford był zawsze gotowy na spotkanie z nieoczekiwanym i wykorzystanie go, gdzie korzystne, ale wiedział również, kiedy zatrzymać się na takich wycieczkach. (Birks, 1962, s. 8)
To było zabawne podejście Rutherforda w akcji. Jego uczniowie i inni wypróbowali jego pomysły, z których wiele było ślepymi zaułkami. Ten pomysł, aby szukać backscatteringu cząstek α, jednak się opłacił., Rutherford napisał (A):
eksperyment, kierowany zdyscyplinowaną wyobraźnią jednostki lub, jeszcze lepiej, grupy jednostek o zróżnicowanym mentalnym spojrzeniu, jest w stanie osiągnąć wyniki, które daleko wykraczają poza wyobraźnię największego filozofa. (Cytat w Eve, 1939, Frontmatter)
jakiś czas później, w 1908 lub 1909, Marsden powiedział, że zgłosił swoje wyniki Rutherfordowi. Rutherford przypomniał to trochę inaczej:
pamiętam …później Geiger przyszedł do mnie z wielkim podnieceniem i powiedział: „udało nam się uzyskać niektóre cząstki α cofające się…,”To było najbardziej niesamowite wydarzenie, jakie w życiu mi się przytrafiło. To było prawie niesamowite, jakbyś wystrzelił 15-calowy pocisk w kawałek bibułki, a on wrócił i cię uderzył. (Rutherford, 1938, s. 68)
pamięć ludzka jest omylna. Niezależnie od tego, czy Marsden czy Geiger powiedzieli Rutherfordowi, efekt był taki sam. Rutherford powiedział, że powinni przygotować publikację z tych badań, które złożyli w maju 1909. Co więcej, to zapoczątkowało myślenie Rutherforda nad tym, co ostatecznie, prawie dwa lata później, opublikował jako teorię atomu.,
co robił Rutherford przez resztę 1909 i cały 1910? Po pierwsze, jego bliski przyjaciel Boltwood był w Manchesterze na rok akademicki pracując z Rutherfordem nad radioaktywnymi produktami rozpadu Radu. Zajmował się także recenzowaniem i wypowiadaniem się na temat wcześniejszych koncepcji dotyczących struktury atomowej. Co najważniejsze, systematycznie analizował zjawisko rozpraszania cząstek α i badał każdy element. Rutherford nie miał śmiałego pomysłu — atomu jądrowego — od razu, ale doszedł do niego stopniowo, rozważając problem z wielu stron.,
jesienią 1910 roku sprowadził Marsdena z powrotem do Manchesteru, aby wraz z Geigerem przeprowadzić rygorystyczne eksperymentalne testy swoich pomysłów. Ponownie ustalili wskaźniki emisji i zakresy cząstek α według źródeł promieniotwórczych i ponownie zbadali swoje analizy statystyczne. Rutherford próbował pogodzić wyniki rozpraszania z różnymi modelami atomowymi, zwłaszcza J. J. Thomsona, w którym dodatnia elektryczność była uważana za rozproszoną równomiernie na całej kuli atomu.
 , Pierwsze wiersze brzmiały: „teoria struktury atomu. Załóżmy, że atom składa się z + ładunku ne w centrum & z-ładunku jako elektronu rozproszonego w całej sferze promienia r. ” On następnie szorstkie pomysły o obliczeniu siły ugięcia na naładowanej cząstki przechodzącej blisko tego naładowanego centrum. Autor: J. B. Birks, ed., Rutherford at Manchester (London: Heywood & , 1962), s. 70.
, Pierwsze wiersze brzmiały: „teoria struktury atomu. Załóżmy, że atom składa się z + ładunku ne w centrum & z-ładunku jako elektronu rozproszonego w całej sferze promienia r. ” On następnie szorstkie pomysły o obliczeniu siły ugięcia na naładowanej cząstki przechodzącej blisko tego naładowanego centrum. Autor: J. B. Birks, ed., Rutherford at Manchester (London: Heywood & , 1962), s. 70.
w pewnym momencie zimą 1910-1911 Rutherford wypracował podstawową ideę atomu z ” naładowanym centrum.,”Jak wskazali Geiger i Marsden w swoim artykule z 1909 roku:
Jeśli wziąć pod uwagę dużą prędkość i masę cząstki α, wydaje się zaskakujące, że niektóre cząstki α, Jak pokazuje eksperyment, mogą być obracane w warstwie 6 x 10-5 cm. złota pod kątem 90°, a nawet więcej. Aby uzyskać podobny efekt przez pole magnetyczne, konieczne byłoby ogromne pole 109 jednostek absolutnych. (Birks, P., 179)
Rutherford stwierdził w swoim artykule z maja 1911 roku, że tak niezwykłe odchylenie w ścieżce masywnej naładowanej cząstki może być osiągnięte tylko wtedy, gdy większość masy, powiedzmy, atomu złota i większość jego ładunku będzie skoncentrowana w bardzo małym ciele centralnym. Uwaga: w tym momencie w 1911 Rutherford nie nazwał tego ” jądrem.”
do odsłuchania tego klipu audio potrzebujesz zainstalowanego Flash Playera.,
pierwsze publiczne ogłoszenie teorii nuklearnej przez Rutherforda nastąpiło na spotkaniu Manchester Literary and Philosophical Society, i zaprosił nas młodych chłopców, aby iść na spotkanie. Powiedział, że ma kilka ciekawych rzeczy do powiedzenia i pomyślał, że chcielibyśmy je usłyszeć. Nie wiedzieliśmy wtedy, o co chodzi. Starsi ludzie w laboratorium wiedzieli, oczywiście Geiger i Marsden wiedzieli, ponieważ już robili eksperymenty. W rzeczywistości, o ile nie zrobili czegoś, co było wystarczające, aby było decydujące, Rutherford nigdy nie wspomniał o tym publicznie., I oczywiście Darwin wiedział o tym znacznie wcześniej. Ale to musiało być na początku 1911 roku, i poszliśmy na spotkanie i powiedział nam. Wspomniał wtedy, że istnieją pewne eksperymentalne dowody, które zostały uzyskane przez Geigera I Marsdena. Nie powiedział, o ile pamiętam, więcej o wynikach niż to, że były one dość decydujące. I, jak już mówiłem, nigdy nie wydałby takiego publicznego ogłoszenia, gdyby nie miał dobrych dowodów., I to jest jedna z cech, które przebiegają przez wszystkie prace Rutherforda, szczególnie przez wszystkie jego prace do końca okresu Manchesteru. Jeśli spojrzeć na niektóre z jego prac z wczesnych dni-Nazywam McGill the early days — był całkiem przekonany, że cząstki alfa to atomy helu, ale nigdy tego nie powiedział w tych słowach. Zawsze mówił, że są albo atomami helu, albo cząsteczkami wodoru, albo może powiedział coś innego o tej wadze., To było dość charakterystyczne dla niego, że nigdy nie powie coś było tak, chyba że miał na to eksperymentalne dowody, które naprawdę go usatysfakcjonowały.
w rzeczywistości Rutherford był niezwykle ostrożny w wyciąganiu wniosków na temat tego centralnego ładunku: „proste obliczenia pokazują, że atom musi być miejscem intensywnego pola elektrycznego, aby wytworzyć tak dużą deflekcję podczas jednego spotkania.”(Birks, s. 183). Szybko i z grubsza wypracował, że kilka związków ilościowych powinno być prawdziwych, jeśli ta podstawowa teoria była poprawna., Po pierwsze, liczba cząstek α rozproszonych pod danym kątem powinna być proporcjonalna do grubości folii. Po drugie, liczba ta powinna być proporcjonalna do kwadratu ładunku jądrowego. Na koniec powinna być odwrotnie proporcjonalna do czwartej potęgi prędkości cząstki α. Te trzy pomysły wyznaczyły eksperymentalny program Geigera I Marsdena na następny rok.
aby odsłuchać ten klip audio potrzebujesz zainstalowanego Flash Playera.,
W McGill niewiele nauczał. Był profesorem nadzwyczajnym. Przypuszczam, że wygłosił kilka wykładów, ale byłoby ich bardzo niewiele. A jego zainteresowanie było dość naturalnie po stronie badawczej. Wygłosił kilka wykładów, ale elementarne wykłady, coś, o czym człowiek powinien wiedzieć, zanim przyjdzie na Uniwersytet. Były to wykłady dla inżynierów. Byli hałaśliwi i Rutherford mógł ich kontrolować., Był może tylko jeden inny człowiek w wydziale, który mógł to zrobić, a on (Rutherford?) podobało im się, ponieważ był w stanie pokazać im bardzo ciekawe eksperymenty, które można wykonać na kursach elementarnych.
często mówi się mi, że Rutherford był złym wykładowcą. Nigdy nie słyszałem takich bzdur. To prawda, że czasami był trochę nudny, trochę zmieszany, ale to było tylko w bardzo rzadkich przypadkach. Były inne okazje, kiedy był naprawdę najbardziej stymulujący. Był w nim ogromny entuzjazm.,
To brzmi dziś dziwnie, więc co sprawiło, że było to rozsądne? Po pierwsze, nie różnił się zbytnio od modelu Thomsona. Po drugie, skoro Rutherford wiedział, że cząstki α zawierają ładunek podwójny +, pomyślał, że może to działać tak samo jak słońce na komecie zamiatającej w pobliżu. To proca cząstki α wokół i z powrotem w kierunku źródła. Rozważał także niemal zapomniany model zaproponowany przez japońskiego fizyka Hantaro Nagaokę — 1865-1950) – Model Saturna., Nagaoka i Rutherford zetknęli się w 1910 i 1911 roku, a Rutherford wspomniał o modelu Nagaoki „centralnej przyciągającej masy otaczającej pierścienie obracających się elektronów” (Birks, str. 203). Ostatecznie w tym krytycznym artykule Rutherforda okazało się jednak, że to, czy atom jest dyskiem czy kulą, a nawet czy ładunek centralny jest dodatni czy ujemny, nie wpłynie na obliczenia. Rutherford był zawsze ostrożny, aby nie twierdzić więcej, niż jego wyniki mogą poprzeć.,
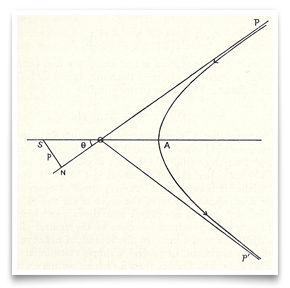 w słynnej pracy Rutherforda z maja 1911 roku na temat rozpraszania cząstek alfa przez złotą folię, zamieścił szkic ścieżki hiperbolicznej cząstki. Kredyt: E. Rutherford, ” the Scattering of α and β Particles by Matter and the Structure of Matter,” Philosophical Magazine, 1911, 21:669-688.
w słynnej pracy Rutherforda z maja 1911 roku na temat rozpraszania cząstek alfa przez złotą folię, zamieścił szkic ścieżki hiperbolicznej cząstki. Kredyt: E. Rutherford, ” the Scattering of α and β Particles by Matter and the Structure of Matter,” Philosophical Magazine, 1911, 21:669-688.
Absorpcja cząsteczek β, jak powiedział, powinna być inna z centrum ujemnym niż z centrum dodatnim., Dodatnie centrum wyjaśniałoby wielką prędkość, jaką cząstki α osiągają podczas emisji z pierwiastków promieniotwórczych. Ale to były tylko wskazówki.
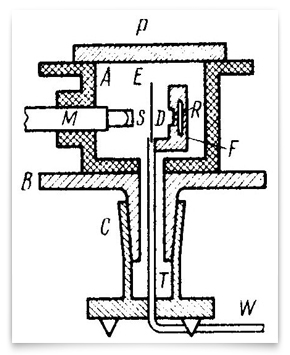 ten schemat przedstawia wyrafinowane eksperymenty z lat 1912-13 podjęte przez Geigera I Marsdena. R było źródłem cząstek alfa, E złotą folią, a m mikroskopem obracającym się wokół pionowej osi wyśrodkowanej na złotej folii. Cząstki alfa ze źródła przechodziły przez membranę D, były rozpraszane przez folię i obserwowane jako scyntylacje na ekranie S., Geiger i Marsden obserwowali kąty rozproszonych cząstek obracając zespół mikroskopu-ekranu. Kredyt: H. Geiger i E. Marsden, „the Laws of Deflexion of α Particles through Large Angles,” Philosophical Magazine, 1913, 25:604-623.
ten schemat przedstawia wyrafinowane eksperymenty z lat 1912-13 podjęte przez Geigera I Marsdena. R było źródłem cząstek alfa, E złotą folią, a m mikroskopem obracającym się wokół pionowej osi wyśrodkowanej na złotej folii. Cząstki alfa ze źródła przechodziły przez membranę D, były rozpraszane przez folię i obserwowane jako scyntylacje na ekranie S., Geiger i Marsden obserwowali kąty rozproszonych cząstek obracając zespół mikroskopu-ekranu. Kredyt: H. Geiger i E. Marsden, „the Laws of Deflexion of α Particles through Large Angles,” Philosophical Magazine, 1913, 25:604-623.
Geiger i Marsden rzeczywiście pracowali systematycznie przez testowalne implikacje hipotezy Centralnego ładunku Rutherforda. W 1912 roku po raz pierwszy opublikowano wyniki badań w języku niemieckim w pracach Wiedeńskiej Akademii Nauk (Sitzungberichte der Wiener Akademie der Wissenschaften)., Ta 30-stronicowa wersja została opublikowana po angielsku w 1913 roku w czasopiśmie filozoficznym: „the Laws of Deflexion of α Particles through Large Angles” wersja angielska jest bardziej znana. Niewielkie różnice między nimi doprowadziły jednego historyka do wniosku, że Rutherford zdecydował się na pozytywnie naładowany Ośrodek do sierpnia 1912 (Trenn, 1974). Inni członkowie zespołu Rutherforda, zwłaszcza Charles Galton Darwin (1887-1962), H. G. J. Moseley (1887-1915) i Niels Bohr (1885-1962) zorientowali się w ostatecznym ustanowieniu atomu jądrowego Rutherforda.,
 The young Henry G. J. Moseley, in the Balliol-Trinity Laboratory, Oxford, ca. 1910. W tym samym roku Moseley rozpoczął badania w Rutherford ' s Manchester lab. Jego błyskotliwa kariera została przerwana w walce podczas I wojny światowej. kredyt: University of Oxford, Museum of the History of Science, dzięki uprzejmości AIP Emilio Segrè Visual Archives, Physics Today Collection.
The young Henry G. J. Moseley, in the Balliol-Trinity Laboratory, Oxford, ca. 1910. W tym samym roku Moseley rozpoczął badania w Rutherford ' s Manchester lab. Jego błyskotliwa kariera została przerwana w walce podczas I wojny światowej. kredyt: University of Oxford, Museum of the History of Science, dzięki uprzejmości AIP Emilio Segrè Visual Archives, Physics Today Collection.
„Wielka Wojna” całkowicie zakłóciła pracę w Manchesterze. Bohr powrócił do Danii. Marsden przyjął profesurę w Nowej Zelandii. Moseley zginął w bitwie pod Gallipoli., James Chadwick (1891-1974), który po wybuchu wojny pracował z Geigerem na Uniwersytecie Technicznym w Berlinie, spędził kilka lat internowany w obozie dla jeńców wojennych w Ruhleben. Inni uczniowie również wyruszyli na wojnę, a Rutherford poświęcił znaczną energię na mobilizację nauki do działań wojennych, a w szczególności na techniki przeciwpodwodne.
 Niels Bohr po raz pierwszy pracował z Rutherford w
Niels Bohr po raz pierwszy pracował z Rutherford w
Manchester w 1912 roku. To zdjęcie pokazuje Młody Niels i Margrethe Bohr, ca., 1914, kiedy Bohr sukces Charles Galton Darwin jako czytelnik Schuster w fizyce matematycznej w Manchesterze. Kredyt: AIP Emilio Segre Visual Archives, Margrethe Bohr Collection.
na tym tle Rutherford i jego pracownik laboratorium, William Kay, rozpoczęli w 1917 roku badania przejścia cząstek α przez wodór, azot i inne gazy. Gdy wielka wojna się skończyła, Ernest Marsden krótko pomógł w żmudnych obserwacjach scyntylacyjnych, które dostarczyły wskazówek na temat natury jądra. Rutherford przedstawił wstępne wyniki tych rozległych eksperymentów w 1919 roku., Rutherford umieścił źródło Radu C (bizmut-214) w zamykanym mosiężnym pojemniku, zamontowanym tak, aby można było zmienić położenie źródła i aby można było wprowadzić różne gazy lub wytwarzać próżnię, zgodnie z życzeniem. Cząstki α przeszły przez wnętrze pojemnika i przeszły przez szczelinę, pokrytą srebrną płytką lub innym materiałem, i trafiły w ekran siarczku cynku, gdzie zaobserwowano scyntylację w zaciemnionym pomieszczeniu. Kiedy Gaz wodorowy został wprowadzony do pojemnika i zadbano o wchłonięcie cząstek α, zanim trafią one w ekran, nadal obserwowano scyntylacje., Rutherford twierdził, że gdy cząstki α przemierzają Gaz wodorowy, czasami zderzają się z jądrami wodoru. Jak pisał Rutherford, wytworzyło to „szybkie atomy wodoru”, które w większości były rzutowane do przodu w kierunku pierwotnego ruchu cząstek α.
Rutherford miał na myśli kilka subtelnych pytań podczas tych eksperymentów, głównie dotyczących natury jądra., Poprosił swojego kolegę Darwina o przeanalizowanie tych zderzeń w oparciu o „prostą teorię” zderzeń sprężystych między jądrami punktowymi odpychanymi zgodnie z odwrotnym prawem kwadratowym, cząstkami α niosącymi ładunek 2 razy większy od elektronu (i o przeciwnym znaku) i jądrami wodoru 1 razy. Darwin odkrył, że wszystkie cząstki α Zbliżające się w odległości 2, 4×10-13 cm wytworzy ” szybki atom wodoru.”Ta prosta teoria przewidywała jednak znacznie mniej przyspieszonych atomów wodoru niż zaobserwowano w eksperymentach.,
Rutherford odrzucił wyjaśnienia tej wariancji w oparciu o różne ładunki na cząstkach lub inne prawa niż prawa odwrotnego kwadratu. Doszedł raczej do wniosku, że dla odległości rzędu średnicy elektronu ” struktura jądra helu nie może być już traktowana jako punkt…”. Postulował, że jądro helu (cząstka α) ma złożoną strukturę czterech jąder wodoru plus dwóch ujemnie naładowanych elektronów. (Powiedzmy, że składa się z dwóch protonów.,) Rutherford doszedł do wniosku, że deformacja złożonych jąder podczas zderzeń jest bardziej prawdopodobnym wyjaśnieniem, zmienność sił między jądrami zmienia się w sposób złożony przy bliskim zbliżeniu.
biorąc pod uwagę intensywne siły wywołane w takich zderzeniach, nie byłoby zaskoczeniem, gdyby jądro helu rozpadło się. Nie zaobserwowano żadnych dowodów na taki rozpad, co wskazywałoby, że jądro helu musi mieć bardzo stabilną strukturę.,
musimy pamiętać, że Rutherford nie mógł bezpośrednio obserwować struktury jądra, więc jego wnioski były niepewne. Niemniej jednak otwarcie rozważał możliwości złożonego jądra, zdolnego do deformacji, a nawet możliwego rozpadu. Te myśli ukształtowały ten intensywny okres badań eksperymentalnych.