reakcja kwasowo-zasadowa (transfer protonów)
dla naszego pierwszego przykładu reaktywności chemicznej, spójrzmy na bardzo prostą reakcję, która zachodzi między jonami wodorotlenku i kwasem solnym:
HCl+OH^- \Rightarrow H_20+CL^-
Blog
dla naszego pierwszego przykładu reaktywności chemicznej, spójrzmy na bardzo prostą reakcję, która zachodzi między jonami wodorotlenku i kwasem solnym:
HCl+OH^- \Rightarrow H_20+CL^-
p>
jest to reakcja kwasowo-zasadowa: Proton jest przenoszony z Hcl, kwasu, do wodorotlenku, zasady. Produktem jest woda (sprzężony kwas wodorotlenku) i Jon chlorkowy (sprzężona podstawa HCl)., Niewątpliwie widzieliście tę reakcję już wcześniej w chemii ogólnej. Pomimo swojej prostoty (i pomimo faktu, że reagenty i produkty są nieorganiczne, a nie organiczne), reakcja ta pozwala nam rozważyć po raz pierwszy wiele podstawowych idei chemii organicznej, które będziemy badać w różnych kontekstach w całym tym tekście.
kluczem do zrozumienia niemal każdego mechanizmu reakcji jest pojęcie gęstości elektronów i tego, w jaki sposób jest on związany z ruchem elektronów (wiązanie i tworzenie wiązań) zachodzącym w reakcji., Jon wodorotlenkowy-konkretnie elektronowy atom tlenu w Jonie wodorotlenkowym-ma wysoką gęstość elektronową ze względu na ładunek ujemny i polaryzację wiązania wodór-tlen. Wodorotlenek tlenu jest bogaty w elektrony.

atom wodoru w HCl, z drugiej strony, ma niską gęstość elektronów: jest ubogi w elektrony. Jak można się spodziewać, coś, co jest bogate w elektrony, przyciąga coś, co jest ubogie w elektrony., Ponieważ wodorotlenek i HCl zbliżają się do siebie, samotna para elektronów na bogatym w elektrony tlenku wodorotlenku jest przyciągana przez ubogie w elektrony proton HCl, a ruch elektronów zachodzi w kierunku protonu. Dwa elektrony w wiązaniu wodorowo-chlor sigma są odpychane przez zbliżającą się gęstość elektronową wodorotlenku, a zatem oddalają się jeszcze dalej od protonu i w kierunku jądra chloru., Konsekwencją całego tego ruchu elektronów jest zerwanie wiązania wodorowo-chlorowego, ponieważ dwa elektrony z tego wiązania całkowicie uwalniają się z orbitala 1s wodoru i stają się samotną parą w orbitalu 3P anionu chlorkowego.
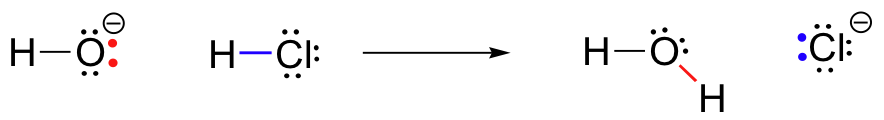
w tym samym czasie, gdy następuje zerwanie wiązania wodorowo-chlorowego, powstaje nowe Wiązanie sigma między wodorem i tlenem, zawierające dwa elektrony, które wcześniej stanowiły samotną parę na wodorotlenku. Rezultatem tego tworzenia się wiązań jest oczywiście cząsteczka wody.
poprzednio (Punkt 6. 1.,), widzieliśmy, jak zakrzywione strzałki zostały użyte do zobrazowania ruchu elektronów, który zachodzi w reakcjach chemicznych, gdzie wiązania są łamane i powstają nowe wiązania. Na przykład reakcja HCl + OH jest przedstawiona przez narysowanie dwóch zakrzywionych strzałek.
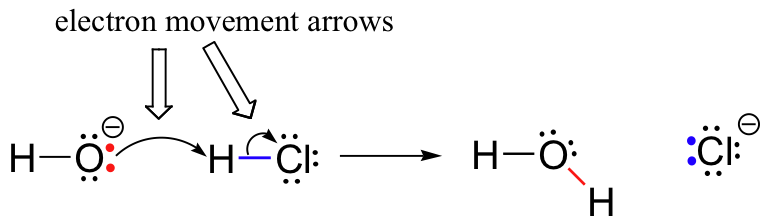
pierwsza strzałka pochodzi z jednej z samotnych par wodorotlenku tlenu i wskazuje na symbol ” H „w cząsteczce bromowodoru, ilustrując „atak” samotnej pary tlenu i późniejsze tworzenie nowego wiązania wodór-tlen., Druga zakrzywiona strzałka pochodzi z wiązania wodorowo-bromowego i wskazuje na symbol „Br”, wskazując, że Wiązanie To ulega zerwaniu – dwa elektrony „odchodzą” i stają się samotną parą na Jonie bromowym.
bardzo ważne jest, aby podkreślić w tym miejscu, że te zakrzywione, dwie strzałki kolczaste zawsze reprezentują ruch dwóch elektronów. Większość tej książki będzie poświęcona opisowi mechanizmów reakcji obejmujących ruch dwóch elektronów, więc te pełnowymiarowe strzały staną się bardzo znane.,

w drugim semestrze przyjrzymy się jednak mechanizmom reakcji radykalnych, w których zachodzi ruch pojedynczego elektronu. W przypadku tych procesów stosuje się zakrzywioną, pojedynczą strzałkę kolczastą („fish-hook”).
narysuj strzałki ruchu elektronów, aby zilustrować reakcję kwasowo-zasadową między kwasem octowym, CH3COOH, a amoniakiem, NH3. Narysuj pełne struktury reagentów i produktów.