wprowadzenie
Adipose-derived stromal cells (ASCs) are multipotent and immunoprivileged, co czyni je idealnymi kandydatami do celów terapeutycznych (Bourin et al., 2013; Ma i in., 2014; Kallmeyer i Pepper, 2015). ASCs można wyizolować przy użyciu technik małoinwazyjnych z różnych magazynów tkanki tłuszczowej w organizmie (Zuk et al., 2001)., Charakteryzują się zdolnością do przylegania do plastiku, unikalnym profilem markera powierzchniowego i zdolnością do różnicowania się w kości, tłuszcz i chrząstki (Dominici et al., 2006; Bourin et al., 2013). ASCs zawiera ~15-30% zrębowej frakcji naczyniowej (SVF) tkanki tłuszczowej (Bourin et al., 2013; Zuk, 2013), i muszą być rozszerzone ex vivo w celu uzyskania wystarczającej liczby komórek do celów terapeutycznych.,
zapewnienie pacjentom bezpiecznych i regulowanych produktów terapii komórkowej wymaga przestrzegania dobrych praktyk produkcyjnych (GMP), a wytyczne GMP powinny być przestrzegane w całym procesie izolowania, rozszerzania i różnicowania ASCs (Giancola et al., 2012). Liczne odczynniki stosowane do izolowania i rozszerzania ASCs do celów badawczych są pochodzenia zwierzęcego lub nie są klasy klinicznej; dlatego należy je zastąpić bardziej odpowiednimi alternatywami zgodnie ze standardami GMP (Halme and Kessler, 2006; Riis et al., 2015)., Przeglądamy wybór suplementacji serum, które można wykorzystać do ekspansji ASC zamiast surowicy bydlęcej płodu (FBS) i opisujemy ich efekty in vitro i In vivo, jak opisano w literaturze.,
International Society of Cellular Therapy (ISCT) i International Fat Applied Technology Society (IFATS) wytyczne i techniki stosowane do oceny charakterystyk komórek Stromalnych pochodzących z tkanki tłuszczowej
zestaw minimalnych kryteriów i wytycznych zostały zalecane przez International Society of Cellular Therapy (ISCT) i International Fat Applied Technology Society (IFATS) do charakterystyki ASCs (Dominici et al., 2006; Bourin et al., 2013)., Kryteria te obejmują zdolność ASCs do przylegania do plastiku, ich profil markera powierzchni i ich potencjał różnicowania trilineage. Najnowsze stanowisko opisuje żywotność i proliferację jako dodatkowe pomiary do pierwotnych kryteriów charakterystyki. Ponadto, metody eksperymentalne i testy zostały zdefiniowane do pomiaru kryteriów charakterystyki (Bourin et al., 2013)., Wykazano, że na kryteria te mają wpływ liczne czynniki, takie jak technika liposukcji, technika izolacji SVF oraz media i suplementacja stosowane podczas procesu ekspansji (Koellensperger et al., 2014; Bajek i in., 2015; Busser et al., 2015). Zgodnie z wytycznymi ISCT i IFATS zaleca się i akceptuje się praktykę badawczą w celu potwierdzenia przestrzegania powyższych wytycznych dla każdego warunku izolacji i hodowli w celu sklasyfikowania wynikowej populacji komórek jako ASCs.,
techniki i metody stosowane do scharakteryzowania ASCs
Morfologia i przyleganie
po wysiewie przylegające ASCs wykazują wyraźną morfologię, którą można określić jako cienką, wydłużoną i wrzecionowatą. Ocena morfologiczna ASCs jest zwykle preformowana za pomocą mikroskopii świetlnej (Trojahn Kølle et al., 2013).
proliferacja
wytyczne ISCT i IFATS zalecały, aby proliferacja i częstotliwość progenitorowych ACSs były mierzone za pomocą testu jednostek tworzących kolonię fibroblastoidów (Bourin et al., 2013)., Inne techniki stosowane w badaniach cytowanych w niniejszym przeglądzie wykorzystują liczenie żywotnych komórek lub pomiar zdolności proliferacyjnej ASCs przy użyciu immunohistochemii. Metody liczenia obejmują (1) liczenie komórek za pomocą barwnika żywotności i hemocytometru, (2) liczenie komórek za pomocą liczenia paciorków lub technik barwienia i analizy cytometrycznej przepływu, oraz (3) za pomocą testów kolorymetrycznych, które mierzą żywotne komórki w spektrofotometrze (Gharibi and Hughes, 2012; Trojahn Kølle et al., 2013; Bogdanova i in., 2014; Atashi i in., 2015; Johal et al., 2015; Oikonomopoulos et al., 2015).,
Immunofenotyp
wytyczne ISCT i IFATS wymieniły wyrażenie wielu markerów powierzchniowych i ich oczekiwane wartości procentowe jako wymóg stanowczy w ich oświadczeniu o pozycji. Zalecili również, że ekspresja markera powierzchni powinny być mierzone przez multi-kolor przeciwciała barwienia (Bourin et al., 2013). Badania w tym przeglądzie wykorzystały analizę cytometryczną przepływu do pomiaru ekspresji markera powierzchniowego (Müller et al., 2006; Lindroos i in., 2009; Chieregato et al., 2011; Josh et al., 2012; Trojahn Kølle et al., 2013; Bogdanova i in., 2014; Patrikoski et al., 2014).,
różnicowanie Trilineage
różnicowanie do tkanki tłuszczowej, kości i chrząstki tradycyjnie mierzono przy użyciu histochemicznych technik barwienia wizualizowanych pod mikroskopem; jednak wytyczne ISCT i IFATS zaleciły, że oceny jakościowe powinny być zastąpione lub uzupełnione o podejścia ilościowe, takie jak pomiar ekspresji mRNA specyficznej dla linii, przy użyciu technik odwrotnej transkrypcji ilościowej reakcji łańcuchowej polimerazy (RT-qPCR) (Bourin et al., 2013)., Techniki, które zostały użyte do pomiaru zdolności różnicowania, opisane w badaniach cytowanych w niniejszym przeglądzie, różniły się od barwienia histochemicznego, do konwencjonalnego PCR i RT-qPCR. Histochemiczne techniki barwienia obejmują barwienie komórek (1) czerwienią olejową o i czerwienią nilową dla adipogenezy; (2) czerwienią Alizarin S, fosfatazą alkaliczną i von Kossa dla osteogenezy; lub (3) błękitem Alcian i safraniną dla chondrogenezy (Müller et al., 2006; Kocaoemer et al., 2007; Hebert et al., 2010; Rajala i in., 2010; Koellensperger et al., 2014; Oikonomopoulos et al., 2015; Riis i in., 2016).,
suplementacja Serum
Serum płodowe bydlęce
FBS to tradycyjny suplement serum stosowany do hodowli komórkowych. FBS zawiera czynniki wzrostu (GFs) i inne elementy niezbędne do ASC przyłączania, ekspansji, utrzymania i proliferacji in vitro (Lennon et al., 1995, 1996; Zuk i in., 2001; van der Valk et al., 2010). FBS jest podatny na zmiany wsadowe, ksenoimmunizację i ewentualne zanieczyszczenie mykoplazmą, wirusami, endotoksynami i prionami (van der Valk et al., 2004, 2010; Chieregato et al., 2011; Kyllonen et al., 2013; Jin i in., 2015)., Źródło i jakość FBS może wpływać na proliferację i różnicowanie ASCs, i rutynowe badania przesiewowe dla mycoplasma, endotoksyn i wirusów stało się ważne (Naaijkens et al., 2012). Czynniki te mogą wpływać na wyniki eksperymentów i uczynić produkt komórkowy niebezpiecznym do stosowania klinicznego (Zuk et al., 2001; van der Valk et al., 2004; Witzeneder et al., 2013).
ASCs są immunoprivileged, brak ekspresji głównych kompleksów zgodności histologicznej klasy II, jak również cząsteczek kosztimulacyjnych komórek T I B (CD80, CD86 i CD40)., Immunogenność in vitro i immunosupresyjne właściwości ASCs są zwykle mierzone przez współwystępowanie ASCs z jednojądrzastymi komórkami krwi obwodowej w mieszanych reakcjach limfocytów i pomiar odpowiedzi proliferacyjnej komórek T (McIntosh et al., 2006; Patrikoski et al., 2014). ASCs wykazują właściwości immunomodulujące i immunosupresyjne, o czym świadczy ich zdolność do regulowania funkcji limfocytów T i modulowania wydzielania cytokin in vitro i In vivo (Leto Barone et al., 2013; Roemeling-van Rhijn et al., 2013; Patrikoski et al., 2014)., Właściwości te wynikają z niskiej immunogenności ASCs. Większość badań klinicznych z ASC i innymi mezenchymalnymi komórkami macierzystymi (MSC) (faza I, II i III) wykorzystuje środki uzupełnione FBS i stwierdzono, że efekty immunogenne są wywoływane przez składniki FBS u ludzi (Sundin et al., 2007; Riis i in., 2015). Na przykład, badanie kliniczne z wykorzystaniem szpiku kostnego-derived MSCS (BM-MSCs) rozszerzone w FBS znaleziono przeciwciał przeciwko składników FBS (Horwitz et al., 2002)., Odpowiedzi immunologiczne na FBS, takie jak Arthus i reakcje anafilaktyczne były zgłaszane w badaniach klinicznych, w których pacjenci byli leczeni komórkami dendrytycznymi i limfocytami narażonymi na FBS (Selvaggi et al., 1997; Mackensen et al., 2000). W przeciwieństwie do tego, metaanaliza badań klinicznych MSC wykazała, że ponad 75% eksperymentów wykorzystywało FBS w swoich protokołach ekspansji komórkowej, a tylko jedno badanie monitorowało i wykazywało działania niepożądane na FBS (Lalu et al., 2012)., Badania in vivo badające odpowiedź immunologiczną myszy na ASCs wykazały zachowaną immunosupresję i immunomodulację, niską immunogenność i brak reakcji na FBS (Cho et al., 2009;, 2009). Chociaż ASCs są intensywnie testowane w badaniach klinicznych, ich ostateczne zastosowanie jako środka terapeutycznego pozostaje do ustalenia. Jest to dodatkowo spotęgowane przez zastosowanie modeli przedklinicznych, które mogą nie być biologicznie istotne (Monsarrat et al., 2016). Ponadto FBS może być mniej immunogenny u myszy i innych modeli zwierzęcych niż u ludzi., Wreszcie, odpowiedź immunologiczna wywołana przez FBS (Selvaggi et al., 1997; Mackensen et al., 2000; Horwitz i in., 2002) może mieć wpływ na odrzucenie przeszczepionych komórek w terapii opartej na komórkach.
Nieznany i nieokreślony skład FBS jest główną wadą. Preferowaną alternatywą byłoby chemicznie zdefiniowane medium o znanym składzie, takie jak dostępne w handlu surowica-free (SF) lub XF media (Usta et al., 2014)., Uważa się, że te pożywki wolne od surowicy są pozbawione jakichkolwiek produktów pochodzenia zwierzęcego, ponieważ terminy SF i XF są często używane zamiennie. Jednak nośniki SF są zwykle uzupełniane albuminami surowicy pochodzenia zwierzęcego lub ludzkiego i GFs w niezdefiniowanych ilościach (Patrikoski et al., 2013). Z drugiej strony, media wolne od Xeno to chemicznie zdefiniowane media zawierające dobrze zdefiniowane składniki w określonych stężeniach (Usta et al., 2014).
czynniki wzrostu
inną alternatywą dla surowicy jest dodanie GFs do pożywki hodowlanej, w izolacji lub jako koktajl., Te GFs mogą być syntetyczne, pochodzenia zwierzęcego lub ludzkiego. Zastąpienie syntetycznych GFs jest preferowane ze względu na ich wyższą jakość i w wyniku standaryzacji między partiami, co może nie być możliwe dla gfs pochodzenia zwierzęcego lub ludzkiego. Powszechnie stosowane GFs są czynnik wzrostu fibroblastów, czynnik wzrostu naskórka i czynnik wzrostu płytek krwi (PDGF; Baer and Geiger, 2012; Ahearne et al., 2014). Dodanie GFs został powiązany ze wzrostem proliferacji (Hebert et al., 2010; Gharibi and Hughes, 2012)., Poprawiony potencjał różnicowania adipogennego został wcześniej zgłoszony w ASCs rozszerzonym w pożywce uzupełnionej GF (Hebert et al., 2010). Jednak w innym badaniu zaobserwowano negatywny wpływ na różnicowanie adipogenne i osteogenne w długoterminowych hodowanych ASCs (Gharibi and Hughes, 2012).
albumina surowicy
albumina surowicy jest obfitym białkiem osocza i może być izolowana od ludzi i zwierząt. Często pożywki SF są uzupełniane albuminami surowicy., Badania porównujące ludzką albuminę surowicy do suplementacji ASC media wykazały lepszą proliferację, mniejszą morfologię podobną do wrzeciona i zachowane różnicowanie do tkanki tłuszczowej, kości i chrząstki (Rajala et al., 2010; Johal et al., 2015).
Chemically-Defined XF Medium
Xeno-free medium został zalecany jako zamiennik FBS i surowicy, ponieważ zawiera składniki niezbędne do ekspansji ASC, nie wymaga dawcy lub partii do partii zmian, jest zgodny z GMP i ma minimalną immunogenność i korzystną immunosupresję (van der Valk et al., 2004, 2010; Usta i in.,, 2014). W porównaniu do FBS, zastosowanie pożywki XF do ekspansji ASCs doprowadziło do lepszej jakości morfologicznej, zwiększonej proliferacji, porównywalnego immunofenotypu i różnicowania się w tkanki tłuszczowej, kości i chrząstki (Lindroos et al., 2009; Patrikoski et al., 2013; Oikonomopoulos et al., 2015). Zastosowanie nośników XF w ekspansji ASC powoduje, że ASCs traci zdolność do przylegania do plastiku (Kyllonen et al., 2013; Patrikoski et al., 2013; Oikonomopoulos et al., 2015). Dodatkowe środki powlekające są potrzebne, aby utrzymać nieodłączną charakterystykę plastiku-przyleganie związane z ASCs., Dostępne na rynku medium XF jest drogie, a przygotowanie wewnętrznego medium XF może być czasochłonne i może zwiększyć ryzyko zmienności partii do partii (Lund et al., 2009; Baer et al., 2010; Rajala i in., 2010; Yang i in., 2012; Kyllonen et al., 2013; Patrikoski et al., 2013; Oikonomopoulos et al., 2015).
Human Alternatives
Human alternatives can replace FBS and SF / XF supplied media and can create a culture environment that more actually remember the human environment (Azouna et al., 2012; Koellensperger et al., 2014)., Ponadto stosowanie produktów autologicznych (pochodzących od tej samej osoby) eliminuje potrzebę badania na obecność czynników zakaźnych i innych czynników chorobotwórczych.
ludzka surowica
Po pozwoleniu na krzepnięcie krwi pełnej w przypadku braku antykoagulantu i odwirowaniu, surowica jest uzyskaną płynną porcją, która nie zawiera płytek krwi, białych krwinek ani czerwonych krwinek (ryc. 1; Stedman, 2006). Surowica ludzka (HS) może być autologiczna (dawca i biorca to ta sama osoba) lub allogeniczna (pochodząca od osób, które różnią się od biorcy)., Zarówno autologiczne i allogeniczne HS są lepsze od FBS (Stute et al., 2004; Bieback et al., 2009, 2012; Bernardo et al., 2011; Kyllonen et al., 2013; Patrikoski et al., 2013). ASCs expanded in HS mają większą stabilność transkryptomu niż te expanded in FBS, podczas gdy geny odpowiedzialne za przedłużenie cyklu komórkowego, różnicowanie i macierz zewnątrzkomórkową i syntezę prostaglandyn są upregulated i overexpressed in FBS w porównaniu z HS using microarray analysis (Shahdadfar et al., 2005)., ASCs rozszerzony w FBS osiągnął starzenie szybciej i wyświetlane telomere skrócenie w porównaniu do ASCs rozszerzony w HS (Shahdadfar et al., 2005). Wybór HS wydaje się mieć niewielki wpływ na właściwości immunomodulujące ASCs. ASCs rozszerzone w allogenicznych HS lub FBS zawierających nośniki miały niską immunogenność i powodowały immunosupresję (Patrikoski et al., 2014). ASCs rozszerzony w autologicznych lub allogenicznych HS wykazują większą proliferację i nierozróżnialny immunofenotyp w porównaniu do ASCs rozszerzony w FBS (Josh et al., 2012; Bogdanova i in., 2014)., ASCs expanded in allogenic HS zostały zróżnicowane do tkanki tłuszczowej, kości i chrząstki, chociaż upregulation chondrogenne i osteogenne geny był faworyzowany w porównaniu do FBS (Josh et al., 2012). ASCs expanded in autologous HS zostały zróżnicowane do tkanki tłuszczowej i chrząstki; jednak zdolność do różnicowania w kości była mniej uprzywilejowana (Bogdanova et al., 2014). Autologiczny HS może zapewnić ASCs z lepszą proliferacją i stabilność genomową, jak określono w analizie mikroarray w porównaniu do allogenicznego HS (Shahdadfar et al., 2005; Bieback et al., 2009; Bernardo et al., 2011)., ASCs rozszerzony w allogeniczne HS wszedł zatrzymanie wzrostu i przeszedł śmierć komórki (Shahdadfar et al., 2005; Lindroos i in., 2009), co ogranicza potencjalne zalety allogenicznych HS. Chociaż autologiczny HS może być idealny, jego dostępność jest ograniczona i może występować istotna różnica między pacjentami w zdolności ich własnej surowicy do wspierania wzrostu własnych komórek (Lange et al., 2007). Alternatywnie allogeniczne HS mogą być łączone, dając większe ilości do eksperymentów laboratoryjnych i mogą być poddawane rygorystycznym testom jakości przez bank krwi (np., przed zastosowaniem u ludzi (Bieback et al., 2009).
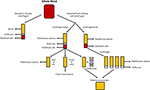
Rysunek 1. Produkcja różnych ludzkich alternatyw. Surowica jest wytwarzana, gdy krew pełna może skrzepnąć i odwirować do granulek czerwonych i białych krwinek i płytek krwi. Plazma jest wytwarzana przez zapobieganie krzepnięciu, a następnie odwirowanie., W zależności od prędkości wirowania Wytwarza się osocze ubogie w płytki krwi (PPP; szybkie odwirowanie) lub osocze bogate w płytki krwi (PRP; wolniejsze odwirowanie). Jeśli PPP jest przechowywany w temperaturze -18°C, jest znany jako świeżo mrożone osocze. Koncentraty płytek krwi można wytwarzać albo przez pobranie osocza ubogiego w płytki krwi i 40 warstw osocza i łączenie ich razem lub odwirowanie wielu PRP i łączenie granulek płytek krwi (zawieszonych w niewielkiej ilości osocza) razem.,
osocze
osocze jest niekomórkową płynną częścią krwi, która zawiera wodę, elektrolity i białka (czynniki krzepnięcia, fibrynogen i leki przeciwzakrzepowe). Osocze ubogie w płytki krwi (PPP), świeżo mrożone osocze (FFP) i osocze bogate w płytki krwi (PRP; ryc. 1) można otrzymać z krwi pełnej przez odwirowanie z różnymi prędkościami, a następnie Przechowywanie w różnych temperaturach. Wydzielanie GF można zwiększyć poprzez aktywację płytek krwi w pełnej krwi za pomocą trombiny przed odwirowaniem (Doucet et al., 2005; Kocaoemer et al.,, 2007), zwiększając tym samym aktywność produktów plazmowych.
osocze ubogie w płytki krwi
PPP jest prawie wolny od płytek krwi i jest wytwarzany z krwi pełnej przez dodanie leku przeciwzakrzepowego podczas procesu pobierania, po czym osocze jest oddzielane za pomocą szybkiego wirowania (Rysunek 1; Koellensperger et al., 2006). Pozwala to na granulację płytek krwi i czerwonych krwinek. Otrzymany PPP jest przechowywany w temperaturze 4°C i jest określany jako świeże osocze., PDGF jest wydzielany przez agregujące się płytki krwi; jednak znikomy PDGF jest uwalniany w PPP w wyniku małej liczby pozostałych płytek krwi. GFs może zatem wymagać dodania do PPP, gdy jest używany w mediach, jak ma to miejsce w przypadku korzystania z medium SF (Müller et al., 2006; Gottipamula et al., 2013). Stosowanie PPP bez dodatku GFs spowodowało mniejsze Tempo proliferacji i mniejszy wzrost syntezy DNA mierzonej przy użyciu wbudowywania tymidyny, w porównaniu z HS i FBS (Vogel et al., 1980; Koellensperger et al., 2006)., PPP z dodatkiem GFs spowodowało wzrost proliferacji w porównaniu do HS (Koellensperger et al., 2006); jednak różnice te mogły wynikać z różnych protokołów produkcji PPP i dodania różnych poziomów GFs do każdego z preparatów PPP w tym badaniu. Ekspansja ASCs w PPP powoduje lepszą proliferację w porównaniu do FBS i ma różnicowanie osteogenne, które jest porównywalne do ASCs expanded in HS (Koellensperger et al., 2014)., Różnicowanie chondrogenne było zmniejszone w ASCs expanded in PPP w porównaniu do ASCs expanded in PRP (Koellensperger et al., 2014).
świeżo mrożone osocze
FFP otrzymuje się w taki sam sposób jak PPP, ale jest zamrażany bezpośrednio po separacji w temperaturze -18°C (O ' Shaughnessy et al., 2004; Liumbruno et al., 2009). FFP został wykorzystany w ekspansji BM-MSCs z pozytywnymi wynikami., Wyniki te obejmują lepszą proliferację, aktywność immunosupresyjną i różnicowanie w adipocyty i osteocyty; oraz immunofenotyp i morfologię, która jest porównywalna do komórek rozszerzonych w FBS (Müller et al., 2006; Mannello i Tonti, 2007). Jednak stosowanie FFP jako substytutu surowicy w ekspansji ASC wymaga dalszych badań.
osocze bogatopłytkowe
PRP to porcja krwi wzbogacona w płytki krwi. PRP jest wytwarzany przez oddzielanie osocza od krwinek czerwonych przy wolniejszych prędkościach wirowania, co zapobiega granulowaniu płytek krwi (ryc. 1)., ASCs expanded in PRP utrzymuje klasyczny immunofenotyp i morfologię, a PRP zwiększa proliferację w porównaniu do FBS (Kocaoemer et al., 2007; Chieregato et al., 2011; Atashi i in., 2015). ASCs rozszerzone w PRP poprawiły skuteczność różnicowania w kierunku adipogennych i osteogennych linii, mając przy tym porównywalną skuteczność różnicowania chondrogennego, w porównaniu do ASCs rozszerzone w FBS (Kocaoemer et al., 2007; Chieregato et al., 2011). W porównaniu, HS okazał się nieco lepszy niż PRP pod względem różnicowania i proliferacji ASCs (Kocaoemer et al.,, 2007; Chieregato et al., 2011). PRP jest słabo zdefiniowanym suplementem pożywki hodowlanej ze względu na dużą zmienność biologiczną i skomplikowaną procedurę ekstrakcji, w której oczyszczanie supernatantu bogatego w czynnik płytkowy z błon osocza może być trudne. Stosowanie PRP jest ograniczone przez duże ilości krwi pełnej potrzebne do uzyskania wystarczającej ilości PRP do eksperymentów (Chieregato et al., 2011).,
lizat płytek krwi
ludzki lizat płytek krwi (Hpl) zawiera GFs płytek krwi, które otrzymuje się przez lizowanie płytek krwi skoncentrowanych w małej objętości osocza (koncentraty płytek krwi; ryc. 1) w wyniku wstrząsu temperaturowego. HPL zawiera większe stężenie GFs niż inne substytuty surowicy, w tym ludzkie PRP i FBS (Doucet et al., 2005; Bernardo et al., 2006, 2011; Bieback i in., 2009; Schallmoser et al., 2010)., HPL można łatwo uzyskać i wyprodukować z produktów aferezy i buffy coats, i można go ponownie zmieszać w PRP lub w roztworze dodatku (Schallmoser and Strunk, 2013; Iudicone et al., 2014). HPL jest wytwarzany przez zamrażanie płytek krwi w temperaturze od -30 do -80°C przez 24 h, a następnie etap rozmrażania i wirowania. Powtarzające się cykle zamrażania, rozmrażania i wirowania pozwalają na uwalnianie GFs i usuwanie ciał płytek krwi (Bernardo et al., 2006; Schallmoser et al., 2007)., Kolejną zaletą suplementacji HPL jest to, że płytki krwi można stosować po 4-5-dniowym terminie ważności krwi (Bieback et al., 2009). HPL jest lepszą alternatywą niż autologiczne i allogeniczne HS, jak ASCS rozszerzony w HPL utrzymać swój klasyczny immunofenotyp, różnicowanie, clonogenne wydajność, czystość komórki, i żywotność komórki (Trojahn Kølle et al., 2013; Riis i in., 2016). HPL wspiera również długotrwałą ekspansję bez uszczerbku dla właściwości immunomodulacyjnych ASCs, mierzonych za pomocą analizy cytometrycznej przepływu (Bieback et al., 2009)., Ekspansja w HPL powoduje krótszy czas podwojenia populacji, skracając czas potrzebny do ekspansji komórek i zmniejszając zagrożenie starzenia się i transformacji (Doucet et al., 2005; Shahdadfar et al., 2005; Bernardo et al., 2006, 2011; Azouna et al., 2012). Bezpieczeństwo biologiczne HPL zostało ocenione za pomocą macierzowej porównawczej hybrydyzacji genomu i kariotypowania widmowego o wysokiej czułości, gdzie stwierdzono, że ASCS rozszerzony w HPL nie miał aberracji chromosomalnych (Crespo-diaz et al., 2011; Trojahn Kølle et al., 2013)., Klasyczna morfologia ASC (cienka, mniejsza, wydłużona i wrzecionowata) jest zachowana w HS i HPL, podczas gdy ASCs rozszerzone w FBS są większe i mniej wrzecionowate (Trojahn Kølle et al., 2013). Chociaż może to wskazywać, że zarówno HS, jak i HPL wybierają prymitywne / niedojrzałe ASCs (Doucet et al., 2005; Bieback et al., 2009), sugeruje również, że komórki wyhodowane w FBS zmniejszyły proliferację i szybciej postępują w kierunku starzenia. HPL różni się między osobami (Bernardo et al., 2006; Crespo-diaz et al., 2011), a zmiana wsadowa na wsadowa jest zmniejszona, gdy HPL jest łączona (Schallmoser et al.,, 2007; Trojahn Kølle et al., 2013). Co więcej, dzięki połączeniu wielu dawców można uzyskać dużą ilość suplementacji, co sprawia, że HPL jest bardziej korzystne niż PRP (Kocaoemer et al., 2007; Bieback i in., 2009; Chieregato et al., 2011).
wnioski
według Riis i wsp. spośród wszystkich zarejestrowanych badań klinicznych z wykorzystaniem rozszerzonych ASCs, które wymieniły warunki ekspansji, większość korzysta z FBS, trzy badania używają autologicznych HS, jedno badanie wykorzystuje PRP, a jedno badanie wykorzystuje HPL (Riis et al., 2015)., Statystyki te są alarmujące, ponieważ FBS może przenosić choroby odzwierzęce po przeszczepieniu komórek, a reakcje immunologiczne przeciwko składnikom FBS zostały zgłoszone (Selvaggi et al., 1997; Mackensen et al., 2000). FBS jest produktem niezgodnym z GMP, ponieważ wpływa na bezpieczeństwo i skuteczność ASC terapeutycznego ,a zatem wymaga wymiany (van der Valk et al., 2004; Kyllonen et al., 2013; Witzeneder et al., 2013). Zostało to naprawione przez zastąpienie FBS chemicznie zdefiniowanymi alternatywami pochodzącymi od ludzi., Zmiana z FBS na alternatywy dla ludzi lub nośniki XF/SF w medycynie regeneracyjnej ma ważną zaletę, że ASCs namnażają się znacznie szybciej w tych ostatnich, co skutkuje większą liczbą komórek do przeszczepu w krótszym czasie. Jednak względna wyższość różnych mediów kulturowych jest nadal szeroko dyskutowana. Badania porównujące więcej niż jedną pożywkę hodowlaną wykazały różne wyniki (Lange et al., 2007; Bernardo et al., 2011; Koellensperger et al., 2014; Riis i in., 2016). Koellensperger et al., porównano różnicowanie Trilineage ASCs rozszerzony w FBS, PRP, PPP i HS (Koellensperger et al., 2014). Ich wyniki ujawniły, że każde medium kulturowe pozwalało na różnicowanie się w jedną lub więcej linii, ale nigdy we wszystkie trzy linie. Kiedy porównano XF media, FBS i HPL uzupełnione media, Riis et al. stwierdzono, że niektóre subpopulacje wyrażały specyficzne markery powierzchniowe w zależności od użytego pożywki hodowlanej (Riis et al., 2016)., Badania porównujące immunofenotyp ASCs rozszerzony w FBS i inne pożywki hodowlane, znaleziono niewiele lub żadnej różnicy w ekspresji markerów powierzchni komórki, niezależnie od markerów badanych (Tabela 1). Gęstość siewu, napięcie tlenu, konfluencja, dysocjacja i wybór podstawowych mediów mogą również wpływać na wyniki eksperymentalne (sotiropoulou et al., 2006; Freshney, 2010; Bourin et al., 2013; Inamdar i Inamdar, 2013; Feng et al., 2014; Riis i in., 2015)., Wybór pożywki hodowlanej zależy od dalszego stosowania tych komórek (podawania zróżnicowanych lub niezróżnicowanych ASCs)i leczonego stanu. Ponadto immunogenność pożywki hodowlanej stosowanej do rozszerzania komórek przed zastosowaniem klinicznym należy uznać za parametr, który może wpływać na wynik kliniczny. W większości badań porównujących różne pożywki hodowlane zastosowano kryteria określone przez ISCT i IFATS w celu potwierdzenia stosowania alternatywy dla FBS., Większość z tych badań bada ASC morfologię, proliferację, immunofenotyp i zdolność tych komórek do różnicowania wzdłuż osteogennych, chondrogennych i adipogennych linii w różnych mediach kulturowych. Niewiele badań zbadało inne aspekty ASCs, takie jak starzenie się, stabilność genetyczna, transkryptom, proteom, immunogenność, wydzielanie cytokin i cykl komórkowy (Shahdadfar et al., 2005; Bieback et al., 2012). Podczas gdy kryteria ISCT i IFATS były próbą ujednolicenia pola pod względem standardowych procedur operacyjnych (Dominici et al., 2006; Bourin et al.,, 2013), nie istnieje konsensus, wokół których właściwości ASCs są istotne dla badań klinicznych, co porównanie różnych mediów kulturowych praktycznie niemożliwe. Chociaż kryteria te zapewniają wymierne wyniki dla łatwego porównania, zmiana komponentów używanych do rozszerzenia ASC może mieć różny wpływ na bezpieczeństwo, skuteczność i odtwarzalność produktów końcowych ASC. Badanie zmian w transcriptome, proteome i secretome ASCs rozszerzać w różny Kultura media jest znacząco, tak jak jest use komórki rozszerzać w różny warunki w odpowiednich przedklinicznych modelach.,

Tabela 1. Wpływ różnych suplementów na ASCs in vitro.
wkład autora
CD MP pomagał w konceptualizacji przeglądu, poprawił i zatwierdził końcowy rękopis. MSP pomagało w konceptualizacji przeglądu, redagowało i zatwierdzało końcowy manuskrypt, a także pozyskiwało fundusze na przedmiotowe projekty. Wszyscy autorzy przeczytali i zatwierdzili ostateczny manuskrypt.,
finansowanie
niniejsze badania i ich publikacja są wynikiem finansowania zapewnionego przez Medical Research Council of South Africa w ramach (a) Projektu MRC ' s Flagships Awards SAMRC-RFA-UFSP-01-2013/komórki macierzyste, a także (b) Jednostka Ekstramuralna do badań i terapii komórek macierzystych. Finansowanie zapewniła również Narodowa Fundacja badawcza RPA.
Oświadczenie o konflikcie interesów
autorzy oświadczają, że badanie zostało przeprowadzone w przypadku braku jakichkolwiek relacji handlowych lub finansowych, które mogłyby być interpretowane jako potencjalny konflikt interesów.,
podziękowania
autorzy pragną podziękować dr Cheryl Tosh za pomoc redakcyjną.
Chieregato, K., Castegnaro, S., Madeo, D., Astori, G., Pegoraro, M., and Rodeghiero, F. (2011). Naskórkowy czynnik wzrostu, podstawowy czynnik wzrostu fibroblastów i czynnik wzrostu pochodzenia płytkowego-bb może zastąpić surowicę bydlęcą płodu i konkurować z ludzkim osoczem bogatopłytkowym w ekspansji ex vivo mezenchymalnych komórek zrębowych pochodzących z tkanki tłuszczowej. Cytotherapy 13, 933-943. podoba mi się! do obserwowanych nr: 65324,583232
PubMed Abstract / CrossRef Full Text / Google Scholar
Mannello, F., And Tonti, G. (2007). Zwięzły przegląd: brak przełomów dla ludzkiej mezenchymalnej i embrionalnej hodowli komórek macierzystych: uwarunkowane medium, warstwa podajnika lub wolne od podajnika; medium z serum płodu cielęcego, surowicy ludzkiej lub wzbogaconego osocza; wolne od surowicy, substytucja serum nonconditioned medium lub formuła ad hoc? wszystko, co błyszczy, nie jest złotem! Komórki Macierzyste 25, 1603-1609. podoba mi się! do obserwowanych nr: 1016342007-0127
PubMed Abstract / CrossRef Full Text / Google Scholar
Selvaggi, T. A., Walker, R. E.,, oraz Fleisher, T. A. (1997). Wytwarzanie przeciwciał w surowicy płodu cielęcego z reakcjami przypominającymi stawonogi u pacjentów zakażonych ludzkim wirusem niedoboru odporności, którym podawano syngenetyczne infuzje limfocytów. Krew 89, 776-779.
PubMed Abstract / Google Scholar
Stedman, T. L. (2006). Słownik medyczny stedmana. Lippincott Williams &
Google Scholar