Konfiguracja elektronowa
elektrony w atomie wypełniają swoje orbitale atomowe zgodnie z zasadą Aufbau;” Aufbau „w języku niemieckim oznacza” budowanie. Zasada Aufbaua, która zawiera zasadę wykluczania Pauli i zasadę Hund ' a, określa kilka prostych zasad, aby określić kolejność, w jakiej elektrony wypełniają orbitale atomowe:
- elektrony zawsze najpierw wypełniają orbitale o niższej energii. 1s jest wypełniony przed 2s, a 2s przed 2p.,
- zasada wykluczenia Pauli ' ego mówi, że żadne dwa elektrony w danym atomie nie mogą mieć identycznych liczb kwantowych. W funkcji zasada ta oznacza, że jeśli dwa elektrony zajmują ten sam orbital, muszą mieć przeciwny spin.
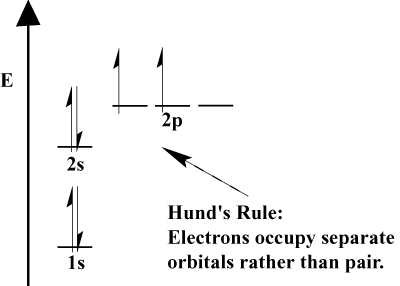
- reguła Hund ' a mówi, że gdy elektron łączy się z atomem i musi wybrać między dwoma lub więcej orbitalami o tej samej energii, elektron woli wejść na pusty orbital, a nie jeden już zajęty., Ponieważ więcej elektronów jest dodawanych do atomu, elektrony te mają tendencję do połowy wypełnienia orbitali tej samej energii przed połączeniem z istniejącymi elektronami w celu wypełnienia orbitali.
Walencja i elektrony walencyjne
najbardziej zewnętrzna powłoka orbitalna atomu nazywa się jego powłoka walencyjna, a elektrony w powłoce walencyjnej są elektrony walencyjne. Elektrony walencyjne są elektrony o najwyższej energii w atomie i dlatego są najbardziej reaktywne. Podczas gdy wewnętrzne elektrony (te nie w powłoce walencyjnej) zazwyczaj nie uczestniczą w wiązaniu chemicznym i reakcjach, elektrony walencyjne mogą być zdobyte, utracone lub dzielone w celu utworzenia wiązań chemicznych., Z tego powodu elementy o tej samej liczbie elektronów walencyjnych mają podobne właściwości chemiczne, ponieważ mają tendencję do zyskiwania, tracenia lub akcji elektronów walencyjnych w ten sam sposób. Układ okresowy został zaprojektowany z myślą o tej funkcji. Każdy pierwiastek ma liczbę elektronów walencyjnych równą jego liczbie grupowej w układzie okresowym.
Ta tabela ilustruje szereg interesujących i skomplikowanych cech konfiguracji elektronowej.,
Po pierwsze, gdy elektrony stają się wyższe w energii, następuje przesunięcie. Do tej pory mówiliśmy, że wraz ze wzrostem liczby kwantowej wzrasta poziom energii orbitalu. I, jak wspomniano powyżej w zasadzie Aufbau, elektrony wypełniają orbitale o niższej energii przed wypełnieniem orbitali o wyższej energii. Jednak powyższy schemat wyraźnie pokazuje, że orbital 4S jest wypełniony przed orbitalem 3D., Innymi słowy, gdy dojdziemy do zasady liczby kwantowej 3, najwyższe podzbiory niższych liczb kwantowych zaćmiają w energii najniższe podzbiory wyższych liczb kwantowych: 3d ma wyższą energię niż 4s.
Po Drugie, powyższe wskazuje na metodę opisu pierwiastka zgodnie z jego konfiguracją elektronową. Podczas przechodzenia od lewej do prawej strony przez układ okresowy, powyższy diagram pokazuje kolejność, w jakiej orbity są wypełnione. Gdybyśmy rzeczywiście rozbić powyższy diagram na grupy, a nie na bloki, które mamy, pokazałoby to, jak dokładnie ile elektronów ma każdy element., Na przykład pierwiastek wodoru, znajdujący się w lewym górnym rogu układu okresowego, jest opisany jako 1S1, gdzie s opisuje, który orbital zawiera elektrony, a 1 opisuje, ile elektronów znajduje się w tym orbitalu. Lit, który znajduje się w układzie okresowym tuż poniżej wodoru, byłby opisany jako 1s22s1. Poniżej przedstawiono konfiguracje elektronów pierwszych dziesięciu pierwiastków (zauważ, że elektrony walencyjne są elektronami w powłoce o najwyższej energii, a nie tylko elektronami w powłoce o najwyższej energii).,

reguła oktetu
nasze omówienie konfiguracji elektronów walencyjnych prowadzi nas do jednej z kardynalnych zasad wiązania chemicznego, reguły oktetu. Reguła oktetu stwierdza, że atomy stają się szczególnie stabilne, gdy ich powłoki walencyjne zyskują pełne dopełnienie elektronów walencyjnych. Na przykład, powyżej, Hel (He) i Neon (Ne) mają zewnętrzne powłoki walencyjne, które są całkowicie wypełnione, więc ani nie ma tendencji do uzyskania lub utraty elektronów., Dlatego też Hel i Neon, dwa z tzw. gazów szlachetnych, występują w swobodnej formie atomowej i zazwyczaj nie tworzą wiązań chemicznych z innymi atomami.
większość pierwiastków nie ma jednak pełnej powłoki zewnętrznej i jest zbyt niestabilna, aby mogła istnieć jako wolne Atomy. Zamiast tego starają się wypełnić swoje zewnętrzne powłoki elektronowe, tworząc wiązania chemiczne z innymi atomami, a tym samym osiągnąć konfigurację gazu szlachetnego. Pierwiastek ma tendencję do pokonywania najkrótszej drogi do osiągnięcia konfiguracji gazu szlachetnego, niezależnie od tego, czy oznacza to uzyskanie, czy utratę jednego elektronu., Na przykład sód (na), który ma pojedynczy elektron w swoim zewnętrznym orbitalu 3s, może stracić ten elektron, aby osiągnąć konfigurację elektronową neonu. Chlor, z siedmioma elektronami walencyjnymi, może uzyskać jeden elektron, aby osiągnąć konfigurację argonu. Gdy dwa różne pierwiastki mają tę samą konfigurację elektronową, nazywa się je izoelektronicznymi.
Diamagnetyzm i Paramagnetyzm
konfiguracja elektronowa atomu ma również wpływ na jego zachowanie w stosunku do pól magnetycznych. Takie zachowanie zależy od liczby elektronów atomu, które są spin sparowane., Pamiętaj, że zasada Hund 'a i zasada wykluczenia Pauli' ego łączą się, aby nakazać, że orbitale atomu wypełnią się w połowie, zanim zaczną całkowicie wypełniać, i że gdy całkowicie wypełnią się dwoma elektronami, te dwa elektrony będą miały przeciwne spiny.
atom z wypełnionymi wszystkimi orbitalami, a zatem wszystkie jego elektrony sparowane z elektronem o przeciwnym spinie, będzie w bardzo niewielkim stopniu oddziaływał na pola magnetyczne. Takie atomy są nazywane diagmetic. Odwrotnie, paramagnetyczne Atomy nie mają wszystkich swoich elektronów spin-sparowanych i są pod wpływem pola magnetycznego., Istnieją stopnie paramagnetyzmu, ponieważ atom może mieć jeden niesparowany elektron lub może mieć cztery.