tlenek żelaza, zwany również nazwą IUPAC trójwodny żelazo lub tlenek żelaza(III), jest związkiem nieorganicznym reprezentowanym przez wzór chemiczny Fe2O3 lub Fe2H6O3 . Jest to jeden z najważniejszych tlenków żelaza, pozostałe dwa to odpowiednio tlenek żelaza (Fe3O4) i tlenek żelaza (FeO). Występuje naturalnie jako minerał hematyt .,
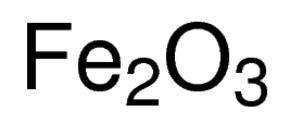
formuła tlenku żelaza
uwodniony tlenek żelaza
jest to czerwonawo-brązowy żelatynowy związek wytwarzany po dodaniu zasad do roztworów zawierających sole Fe(III). Jest również nazywany wodnym tlenkiem żelaza i może być chemicznie reprezentowany jako Fe2O3.H2O lub Fe (O)OH . Niektóre typowe formy uwodnionego tlenku żelaza obejmują czerwony lepidokrocyt, który występuje zewnętrznie w rustykalnych i pomarańczowy goethit, który występuje wewnątrz rustykalnych.,
jak powstaje tlenek żelaza
tlenek żelaza jest syntetyzowany w laboratorium poprzez elektrolizę roztworu wodorowęglanu sodu, który działa jako obojętny elektrolit i anoda żelaza. Elektrolityczna przemiana żelaza w uwodniony tlenek żelaza(III) jest reprezentowana jako:
4Fe + 3O2 + 2H2O → 4 FeO (OH)
w ten sposób uwodniony tlenek żelaza (III) ulega odwodnieniu w temperaturze około 200 °C, tworząc tlenek żelaza ., do siarczanu żelaza (FeSO4), który jest dalej utleniany do siarczanu żelaza :
- FeS2 + 7o+ H2O → FeSO4 + H2SO4
- 2feso4 + H2SO4 + o → Fe2(SO4)3 + H2O
Aluminium zastępuje żelazo z tlenku żelaza
aluminium i tlenek żelaza przechodzą reakcję redoks, w której metal zastępuje żelazo w celu utworzenia Aluminium tlenek:
Fe2O3 + 2AL → Al2O3 + 2FE
właściwości i właściwości tlenku żelaza
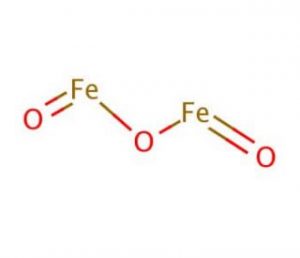
struktura tlenku żelaza
zastosowania
- w przemyśle żelaza do produkcji stali i stopów .,
- proszek tlenku żelaza, zwany również różem jubilerskim, służy do polerowania soczewek i metalowej biżuterii .
- jego granulowana forma jest wykorzystywana jako medium filtracyjne do wyciągania fosforanów w akwariach morskich .
- jako zatwierdzony przez FDA Pigment Brown 6 i Pigment Red 101, do stosowania w kosmetykach .
- w zastosowaniach biomedycznych, ponieważ jego nanocząstki są nietoksyczne i biokompatybilne .
czy jest niebezpieczny
długotrwałe narażenie na opary lub kurz może spowodować pneumokoniozę z gorączką, dreszczami, bólami, dusznością i kaszlem ., Powtarzający się kontakt z oczami może odbarwić go i spowodować trwałe zabarwienie żelaza .
- tlenek żelaza(III) – Chemspider.com
- tlenek żelaza czerwony – Pubchem.ncbi.nlm.hih.gov
- magnetyt (Fe3O4) – Pubchem.ncbi.nlm.nih.gov
- tlenek żelaza – Pubchem.ncbi.nlm.nih.gov
- chebi:50819-tlenek żelaza – Ebi.ac.uk
- pył i opary tlenku żelaza (jako Fe) – Cdc.gov
- Kinetyka i mechanizm odwadniania γ-FeOOH – Researchgate.net
- cząsteczki tlenku żelaza(III) – Americanelements.com
- tlenek żelaza-Książka chemiczna.,com
- właściwości magnetyczne materiałów – Sigmaaldrich.com
- tlenek żelaza(III) – Chem.libretexts.org
- tlenek żelaza (Fe2O3), hydrat (związek) – Pubchem.ncbi.nlm.nih.gov
- utlenianie siarczanu żelaza do siarczanu żelaza za pomocą powietrza – Archive.org
- zastosowanie tlenku żelaza – Zjunited.com
- arkusz informacyjny dotyczący substancji niebezpiecznych tlenek żelaza – Nj.gov