jak działa bufor?
bufor jest w stanie oprzeć się zmianie pH, ponieważ dwa składniki (sprzężony kwas i sprzężona zasada) są obecne w znacznych ilościach w równowadze i są w stanie zneutralizować niewielkie ilości innych kwasów i zasad (w postaci H3O+ i OH -), gdy są dodawane do roztworu. Aby wyjaśnić ten efekt, możemy rozważyć prosty przykład kwasu fluorowodorowego (HF) i buforu fluorku sodu (Naf)., Kwas fluorowodorowy jest słabym kwasem ze względu na silne przyciąganie pomiędzy stosunkowo małymi jonami F i solwatowanymi protonami (H3O+), co nie pozwala mu całkowicie dysocjować w wodzie. Dlatego, jeśli otrzymamy HF w roztworze wodnym, ustalamy następującą równowagę z tylko niewielką dysocjacją (Ka(HF) = 6, 6×10-4, silnie sprzyja reagentom):
\
możemy następnie dodać i rozpuścić fluorek sodu w roztworze i wymieszać te dwa, aż osiągniemy pożądaną objętość i pH, przy którym chcemy się buforować., Gdy fluorek sodu rozpuszcza się w wodzie, reakcja kończy się, więc otrzymujemy:
\
ponieważ Na+ jest koniugatem silnej zasady, nie ma to wpływu na pH ani reaktywność bufora. Dodanie \(NaF\) do roztworu zwiększy jednak stężenie F-w roztworze buforowym, a w konsekwencji, zgodnie z zasadą Le Chateliera, doprowadzi do nieco mniejszej dysocjacji HF również w poprzedniej równowadze. Obecność znacznych ilości zarówno sprzężonego kwasu, \(HF\), jak i sprzężonej Zasady, F -, pozwala na działanie roztworu jako bufora., To działanie buforujące można zobaczyć na krzywej miareczkowania roztworu buforowego.
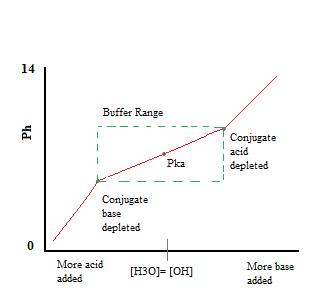
jak widać, ponad zakresem roboczym bufora. pH zmienia się bardzo niewiele z dodatkiem kwasu lub zasady. Po przekroczeniu zdolności buforowej szybkość zmiany pH szybko skacze. Dzieje się tak, ponieważ sprzężony kwas lub zasada zostały wyczerpane przez neutralizację. Zasada ta oznacza, że większa ilość sprzężonego kwasu lub zasady będzie miała większą zdolność buforowania.,
Jeśli kwas został dodany:
\
w tej reakcji, sprzężona zasada, F-, zneutralizuje dodany kwas, H3O+, i reakcja ta przechodzi do końca, ponieważ reakcja F – z H3O+ ma stałą równowagi znacznie większą niż jedna. (W rzeczywistości stała równowagi reakcji jak zapisano jest odwrotnością Ka dla HF: 1/Ka(HF) = 1 / (6.6×10-4) = 1.5×10+3.,) Tak długo, jak jest więcej F-niż H3O+, prawie cała H3O+ zostanie zużyta, a równowaga przesunie się w prawo, nieznacznie zwiększając stężenie HF i nieznacznie zmniejszając stężenie F -, ale powodując prawie żadną zmianę ilości H3O + obecnej po przywróceniu równowagi.,
Jeśli dodana została zasada:
\
w tej reakcji sprzężony kwas HF zneutralizuje dodane ilości Zasady OH -, a równowaga ponownie przesunie się w prawo, nieznacznie zwiększając stężenie F – w roztworze i nieznacznie zmniejszając ilość HF. Ponownie, ponieważ większość OH – jest zneutralizowana, nastąpi niewielka zmiana pH.
te dwie reakcje mogą nadal zmieniać się tam iz powrotem z niewielką zmianą pH.