Nem todas as Colisões são Iguais
Por um gás à temperatura ambiente e pressão atmosférica normal, há cerca de 1033 colisões em cada centímetro cúbico de espaço a cada segundo. Se cada colisão entre duas moléculas reagentes produzisse produtos, Todas as reações seriam completas em uma fração de segundo. Por exemplo, quando duas bolas de bilhar colidem, elas simplesmente saltam umas das outras., Este é o resultado mais provável se a reação entre A e B requer uma ruptura significativa ou rearranjo das ligações entre seus átomos. A fim de iniciar efetivamente uma reação, as colisões devem ser suficientemente energéticas (ou ter energia cinética suficiente) para provocar essa ruptura da ligação. Isto é discutido mais adiante.
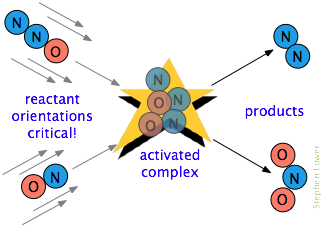
existe frequentemente um requisito adicional. Em muitas reações, especialmente aquelas que envolvem moléculas mais complexas, as espécies que reagem devem ser orientadas de uma maneira que seja apropriada para o processo particular., Por exemplo, na reação de fase gasosa do óxido de dinitrogênio com óxido nítrico, a extremidade de oxigênio do N2O deve atingir a extremidade de nitrogênio do NO; alterar a orientação de cada molécula impede a reação. Devido à extensa aleatorização dos movimentos moleculares em um gás ou líquido, há sempre moléculas suficientemente orientadas corretamente para que algumas das moléculas reajam. No entanto, quanto mais crítica for esta exigência orientacional, menos colisões serão eficazes.,colisões energéticas entre moléculas causam ligações interatômicas para esticar e dobrar, enfraquecendo-as temporariamente para que se tornem mais suscetíveis à clivagem. Distorção das ligações pode expor suas nuvens elétricas associadas a interações com outros reagentes que podem levar à formação de novas ligações.,
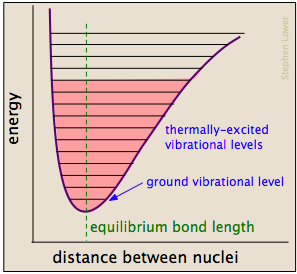
as ligações Químicas de ter algumas das propriedades da mecânica springs: suas energias potenciais dependem da medida em que eles são esticado ou comprimido. Cada ligação átomo-a-átomo pode ser descrita por um diagrama de energia potencial que mostra como a sua energia muda com o seu comprimento., Quando a ligação absorve energia (tanto do aquecimento como através de uma colisão), é elevada a um estado vibracional quantizado mais elevado (indicado pelas linhas horizontais) que enfraquece a ligação à medida que o seu comprimento oscila entre os limites alargados correspondentes à curva.
uma colisão particular normalmente excita um número de ligações desta forma. Dentro de cerca de 10-13 segundos, esta excitação é distribuída entre as outras ligações na molécula de formas complexas e imprevisíveis que podem concentrar a energia adicionada em um ponto particularmente vulnerável., A ligação afetada pode esticar e dobrar mais, tornando-se mais suscetível à clivagem. Mesmo que a ligação não se quebre por puro alongamento, ela pode se tornar distorcida ou torcida de modo a expor as nuvens elétricas próximas a interações com outros reagentes que podem encorajar uma reação.