Configuração eletrônica
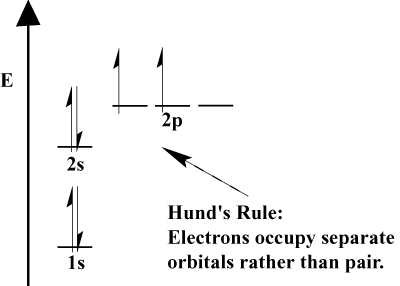
Os elétrons em um átomo de preenchimento orbitais atómicas, de acordo com o Princípio de Aufbau; “Aufbau”, em alemão, significa “construção.”O Princípio de Aufbau, que incorpora o Princípio de Exclusão de Pauli e Regra de Hund prescreve algumas regras simples para determinar a ordem na qual os elétrons de preenchimento de orbitais atómicas:
- Elétrons sempre de preenchimento de orbitais de menor energia. 1s é preenchido antes de 2s, e 2s antes de 2p.,
- O princípio de exclusão de Pauli afirma que dois elétrons dentro de um átomo particular não podem ter números quânticos idênticos. Em função, este princípio significa que se dois elétrons ocupam o mesmo orbital, eles devem ter spin oposto.a regra de Hund afirma que quando um elétron se junta a um átomo e tem que escolher entre dois ou mais orbitais da mesma energia, o elétron preferirá entrar em uma orbital vazia ao invés de uma já ocupada., À medida que mais elétrons são adicionados ao átomo, estes elétrons tendem a preencher orbitais da mesma energia antes de se emparelhar com elétrons existentes para preencher orbitais.
Valency e Valência Elétrons
O orbital mais externo de um átomo é chamada de sua valence shell, e os elétrons em valence shell são elétrons de valência. Os elétrons de Valência são os elétrons de maior energia de um átomo e são, portanto, os mais reativos. Enquanto elétrons internos (aqueles que não estão na concha de Valência) normalmente não participam em ligações químicas e reações, elétrons de Valência podem ser adquiridos, perdidos ou compartilhados para formar ligações químicas., Por esta razão, elementos com o mesmo número de elétrons de Valência tendem a ter propriedades químicas semelhantes, uma vez que tendem a ganhar, perder ou compartilhar elétrons de valência da mesma forma. A Tabela Periódica foi desenhada com esta característica em mente. Cada elemento tem um número de elétrons de Valência igual ao seu número de grupo na Tabela Periódica.
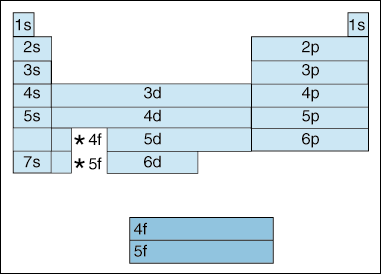
Esta tabela ilustra um número de interessante, e para complicar, as características da configuração eletrônica., em primeiro lugar, à medida que os electrões se tornam mais elevados em energia, ocorre uma mudança. Até agora, temos dito que como o número quântico principal, aumenta, assim como o nível de energia do orbital. E, como afirmamos acima no princípio de Aufbau, os elétrons preenchem orbitais de menor energia antes de preencherem orbitais de maior energia. No entanto, o diagrama acima mostra claramente que o orbital 4s é preenchido antes do orbital 3d., Em outras palavras, uma vez que podemos obter a princípio quântico, número 3, o mais alto subshells dos menores números quânticos no eclipse de energia mais baixo subshells de maior números quânticos: o 3d é de maior energia do que o 4s.
em Segundo lugar, acima indica um método de descrever um elemento de acordo com a sua configuração eletrônica. À medida que você se move da esquerda para a direita através da tabela periódica, o diagrama acima mostra a ordem em que orbitais são preenchidos. Se fôssemos realmente a quebrar o diagrama acima em grupos ao invés dos blocos que temos, isso mostraria exatamente quantos elétrons cada elemento tem., Por exemplo, o elemento de hidrogênio, localizado no canto superior esquerdo da tabela periódica, é descrito como 1s1, com o s descrevendo qual orbital contém elétrons e o 1 descrevendo quantos elétrons residem nesse orbital. Lítio, que reside na tabela periódica logo abaixo do hidrogênio, seria descrito como 1s22s1. As configurações dos elétrons dos primeiros dez elementos são mostradas abaixo (note que os elétrons de Valência são o elétron na camada de energia mais alta, não apenas os elétrons na camada de energia mais alta).,

A Regra do Octeto
a Nossa discussão de valência elétrons configurações de leva-nos a um dos cardeais princípios de ligação química, a regra do octeto. A Regra do octeto afirma que os átomos se tornam especialmente estáveis quando suas conchas de Valência ganham um complemento completo de elétrons de Valência. Por exemplo, em cima, Hélio (He) e néon (Ne) têm conchas de Valência exteriores que são completamente preenchidas, portanto, nem tem uma tendência para ganhar ou perder elétrons., Portanto, o hélio e o néon, dois dos chamados gases nobres, existem em forma atômica livre e geralmente não formam ligações químicas com outros átomos.
A maioria dos elementos, no entanto, não tem uma concha exterior completa e são muito instáveis para existir como átomos livres. Em vez disso, procuram encher as suas conchas de electrões exteriores formando ligações químicas com outros átomos e, assim, atingir a configuração de gases nobres. Um elemento tenderá a tomar o caminho mais curto para alcançar a configuração de gás nobre, quer isso signifique ganhar ou perder um elétron., Por exemplo, o sódio (na), que tem um único elétron em seu orbital exterior de 3s, pode perder esse elétron para atingir a configuração eletrônica do neon. O cloro, com sete elétrons de Valência, pode ganhar um elétron para atingir a configuração de argônio. Quando dois elementos diferentes têm a mesma configuração eletrônica, eles são chamados de isoeletrônicos.
diamagnetismo e paramagnetismo
a configuração eletrônica de um átomo também tem consequências sobre o seu comportamento em relação aos campos magnéticos. Tal comportamento é dependente do número de elétrons que um átomo tem que são spin emparelhados., Lembrem-se que a regra de Hund e o princípio de exclusão de Pauli combinam-se para ditar que os orbitais de um átomo vão encher-se antes de começarem a encher-se completamente, e que quando se encherem completamente com dois electrões, esses dois electrões terão voltas opostas.um átomo com todos os seus orbitais cheios, e portanto todos os seus elétrons emparelhados com um elétron de spin oposto, será muito pouco afetado por campos magnéticos. Tais átomos são chamados diagméticos. Inversamente, átomos paramagnéticos não têm todos os seus elétrons spin-Pared e são afetados por campos magnéticos., Há graus de paramagnetismo, uma vez que um átomo pode ter um electrão não emparelhado, ou pode ter quatro.