Introdução
Adiposo-derivadas de células do estroma (ASCs) são multipotent e immunoprivileged, tornando-os ideais candidatos para fins terapêuticos (Bourin et al., 2013; Ma et al., 2014; Kallmeyer and Pepper, 2015). A ASCs pode ser isolada usando técnicas minimamente invasivas a partir de vários depósitos de tecido adiposo no corpo (Zuk et al., 2001)., Eles são caracterizados pela sua capacidade de aderir ao plástico, um perfil de superfície único e a capacidade de diferenciar em osso, gordura e cartilagem (Dominici et al., 2006; Bourin et al., 2013). As ASCs compreendem cerca de 15-30% da fracção vascular estromal (SVF) do tecido adiposo (Bourin et al., 2013; Zuk, 2013), e precisa ser expandido ex vivo para obter números de células suficientes para fins terapêuticos.,o fornecimento de produtos de terapia celular seguros e regulamentados aos doentes requer a adesão a boas práticas de fabrico (BPF), e as orientações para as BPF devem ser seguidas durante todo o processo de isolamento, expansão e diferenciação da ASC (Giancola et al., 2012). Os numerosos reagentes utilizados para isolar e expandir as ASCs para fins de investigação são derivados de animais ou não são de qualidade clínica; por conseguinte, estes devem ser substituídos por alternativas mais adequadas de acordo com os padrões de GMP (Halme e Kessler, 2006; Riis et al., 2015)., Revisamos a escolha da suplementação sérica que pode ser usada para expansão da ASC em vez do soro fetal bovino (FBS), e descrevemos seus efeitos in vitro e in vivo como relatado na literatura.,
Sociedade Internacional de Terapia Celular (ISCT) e Internacional de Gordura Tecnologia Aplicada à Sociedade (IFATS) Diretrizes e Técnicas Utilizadas para Avaliar Adiposo-Derivadas do Estroma de Células Características
Um conjunto de critérios mínimos e diretrizes tenham sido recomendados pela Sociedade Internacional de Terapia Celular (ISCT) e Internacional de Gordura Tecnologia Aplicada à Sociedade (IFATS) para a caracterização do ASCs (Dominici et al., 2006; Bourin et al., 2013)., Estes critérios incluem a capacidade de os ASCs aderirem ao plástico, o seu perfil de marcador de superfície e o seu potencial de diferenciação das triinagens. O último documento de posição descreve a viabilidade e proliferação como medições adicionais aos critérios de caracterização originais. Além disso, foram definidos métodos e ensaios experimentais para medir os critérios de caracterização (Bourin et al., 2013)., Estes critérios têm sido mostrados como afetados por inúmeros fatores como a técnica de lipoaspiração, a técnica de isolamento SVF e os meios de comunicação e suplementação utilizados durante o processo de expansão (Koellensperger et al., 2014; Bajek et al., 2015; Busser et al., 2015). De acordo com as Diretrizes ISCT e IFATS, recomenda-se e aceita a prática de pesquisa para confirmar a adesão às diretrizes acima para cada condição de isolamento e cultura, a fim de classificar a população celular resultante como ASCs.,
técnicas e métodos utilizados para caracterizar as ASCs
morfologia e aderência
uma vez semeada, as Asces aderentes apresentam uma morfologia distinta, que pode ser descrita como Fina, alongada e em forma de fuso. A avaliação morfológica da ASCs é geralmente pré-formada por microscopia de luz (Trojahn Kølle et al., 2013).proliferação
proliferação
as directrizes ISCT e IFATS recomendaram que a proliferação e a frequência dos sistemas ACSs progenitores sejam medidos por um doseamento unitário formador de colónias de fibroblastóides (Bourin et al., 2013)., Outras técnicas utilizadas nos estudos citados nesta revisão utilizam a contagem de células viáveis ou a medição da capacidade proliferativa da ASCs utilizando imunohistoquímica. Os métodos de contagem, incluem: (1) contagem de células usando um corante de viabilidade e um hemocytometer, (2), a contagem de células usando um rosários ou técnicas de coloração e análise por citometria de fluxo, e (3) usar colorimétrica ensaios que medem de células viáveis em um espectrofotômetro (Gharibi e Hughes, 2012; Trojahn Kølle et al., 2013; Bogdanova et al., 2014; Atashi et al., 2015; Johal et al., 2015; Oikonomopoulos et al., 2015).,
Imunofenótipo
as orientações ISCT e IFATS listaram a expressão de marcadores de superfície múltiplos e as suas percentagens esperadas como um requisito firme na sua declaração de posição. Também recomendaram que a expressão do marcador de superfície seja medida por coloração de anticorpos multicoloridos (Bourin et al., 2013). Estudos nesta revisão fizeram uso da análise citométrica de fluxo para medir a expressão do marcador de superfície (Müller et al., 2006; Lindroos et al., 2009; Chieregato et al., 2011; Josh et al., 2012; Trojahn Kølle et al., 2013; Bogdanova et al., 2014; Patrikoski et al., 2014).,
Trilineage Diferenciação
Diferenciação em tecido adiposo, ossos e cartilagem tem sido tradicionalmente medido utilizando técnicas de coloração histoquímica visualizados sob microscopia; no entanto, o ISCT e IFATS diretrizes recomendam que as avaliações qualitativas devem ser substituídos ou complementados com abordagens quantitativas, tais como a medição linhagem-específicos de mRNA de expressão usando transcrição reversa quantitativa reação em cadeia da polimerase (RT-de acordo com pcr) técnicas (Bourin et al., 2013)., As técnicas utilizadas para medir a capacidade de diferenciação, descritas nos estudos citados nesta revisão, variaram desde a coloração histoquímica até a PCR convencional e RT-qPCR. As técnicas de coloração histoquímica incluem coloração das células com (1) Vermelho de óleo o e vermelho de Nilo para a adipogénese; (2) vermelho de alizarina S, fosfatase alcalina e von Kosta para a osteogénese; ou (3) Azul de Cancian e safranina para a condrogénese (Müller et al., 2006; Kocaoemer et al., 2007; Hebert et al., 2010; Rajala et al., 2010; Koellensperger et al., 2014; Oikonomopoulos et al., 2015; Riis et al., 2016).,
Suplemento sérico
soro Fetal bovino
FBS é o suplemento sérico tradicional utilizado para a cultura celular. A FBS contém factores de crescimento (GFs) e outros elementos essenciais para a fixação, expansão, manutenção e proliferação in vitro (Lennon et al., 1995, 1996; Zuk et al., 2001; van der Valk et al., 2010). A FBS é propensa à variação lote-a-lote, xenoimmunização e possível contaminação com micoplasma, vírus, endotoxinas e priões (van der Valk et al., 2004, 2010; Chieregato et al., 2011; Kyllonen et al., 2013; Jin et al., 2015)., A origem e a qualidade dos EBE podem afectar a proliferação e a diferenciação dos ASCs, tendo-se tornado importante o rastreio de rotina de micoplasma, endotoxinas e vírus (Naaijkens et al., 2012). Estes factores podem afectar os resultados experimentais e tornar o produto celular inseguro para utilização clínica (Zuk et al., 2001; van der Valk et al., 2004; Witzeneder et al., 2013).
ASCs são imunoprivilegiados, faltando a expressão do principal complexo de histocompatibilidade classe II, bem como as moléculas de co-estimulação das células T e B (CD80, CD86 e CD40)., A imunogenicidade e as propriedades imunossupressoras in vitro da ASCs são geralmente medidas através da co-cultura da ASCs com células mononucleares do sangue periférico em reacções de linfócitos mistos e da medição da resposta proliferativa das células T (McIntosh et al., 2006; Patrikoski et al., 2014). As ASCs demonstram propriedades imunomoduladoras e imunossupressoras, como demonstrado pela sua capacidade para regular a função das células T e modular a secreção de citoquinas in vitro e in vivo (Leto Barone et al., 2013; Roemeling-van Rhijn et al., 2013; Patrikoski et al., 2014)., Estas propriedades resultam da baixa imunogenicidade da ASCs. A maioria dos ensaios clínicos com células estaminais mesenquimais (MSC) (Fase I, II e III) utilizam meios suplementados com FBS, e foi relatado que os efeitos imunogénicos são induzidos por componentes de FBS em indivíduos humanos (Sundin et al., 2007; Riis et al., 2015). Por exemplo, um ensaio clínico com MSCs derivados da medula óssea (BM-MSCs) expandido na FBS encontrou anticorpos contra Componentes da FBS (Horwitz et al., 2002)., Nos ensaios clínicos foram notificadas respostas imunitárias à FBS, tais como Arthus e reacções anafilácticas, nos quais os doentes foram tratados com células dendríticas e linfócitos expostos à FBS (Selvaggi et al., 1997; Mackensen et al., 2000). Em contraste, uma meta-análise de ensaios clínicos com MSC revelou que mais de 75% das experiências utilizaram a FBS nos seus protocolos de expansão celular e apenas um estudo monitorizou e demonstrou reacções adversas à FBS (Lalu et al., 2012)., Estudos In vivo que examinaram a resposta imunitária dos ratinhos à ASCs mostraram imunossupressão e imunomodulação preservadas, baixa imunogenicidade e nenhuma reacção à FBS (Cho e al., 2009; González et al., 2009). Embora as ASCs estejam a ser extensivamente testadas em ensaios clínicos, o seu uso definitivo como agente terapêutico permanece por estabelecer. Isto é ainda agravado pela utilização de modelos pré-clínicos que podem não ser biologicamente relevantes (Monsarrat et al., 2016). Além disso, a FBS pode ser menos imunogénica em ratinhos e noutros modelos animais do que em seres humanos., Finalmente, a resposta imunitária provocada pela FBS (Selvaggi et al., 1997; Mackensen et al., 2000; Horwitz et al., 2002) poderia influenciar a rejeição de células transplantadas em Terapia Celular.
alternativas sem soro
a composição desconhecida e indefinida da FBS é uma grande desvantagem. Uma alternativa preferível seria um meio quimicamente definido com uma composição conhecida, tais como soro livre (SF) comercialmente disponível ou meio XF (Usta et al., 2014)., Estes meios livres de soro são erroneamente presumidos desprovidos de quaisquer produtos animais, uma vez que os Termos SF e XF são frequentemente utilizados indistintamente. No entanto, os meios de comunicação SF são geralmente complementados com albumina sérica humana ou animal e GFs em quantidades indefinidas (Patrikoski et al., 2013). Os meios livres de Xeno, por outro lado, são meios quimicamente definidos que contêm componentes bem definidos em concentrações específicas (Usta et al., 2014).factores de crescimento
outra alternativa ao soro é a adição de FP ao meio de cultura, isoladamente ou como cocktail., Estas GFs podem ser sintéticas, derivadas de animais ou derivadas de humanos. A substituição por GFs sintéticas é preferível devido à sua maior qualidade e em resultado da normalização entre lotes, o que pode não ser possível para GFs de origem animal ou humana. GFs comumente usados são fibroblastos fator de crescimento, fator de crescimento epidérmico e fator de crescimento derivado de plaquetas (PDGF; Baer e Geiger, 2012; Ahearne et al., 2014). A adição de GFs tem sido associada a um aumento na proliferação (Hebert et al., 2010; Gharibi e Hughes, 2012)., Um potencial de diferenciação adipogénica melhorado foi anteriormente notificado em ASCs expandido em meio suplementado com GF (Hebert et al., 2010). No entanto, outro estudo observou um efeito negativo na diferenciação adipogénica e osteogénica em ASCs cultivadas a longo prazo (Gharibi e Hughes, 2012).a albumina sérica é uma proteína plasmática abundante e pode ser isolada a partir de humanos e animais. Frequentemente, os meios de SF são complementados com albumina sérica., Estudos que compararam a albumina sérica humana para suplementação com meios ASC encontraram uma proliferação melhorada, uma morfologia semelhante ao fuso menor e diferenciação preservada em adipose, osso e cartilagem (Rajala et al., 2010; Johal et al., 2015).
meio XF quimicamente definido
meio Xeno-livre foi recomendado como um substituto para FBS e soro, uma vez que contém os componentes necessários para a expansão da ASC, não envolve a variação dador ou lote-a-lote, é compatível com GMP e tem imunogenicidade mínima e imunossupressão favorável (van der Valk et al., 2004, 2010; Usta et al.,, 2014). Em comparação com a FBS, o uso de meio XF para a expansão da ASCs levou a uma melhor qualidade morfológica, aumento da proliferação, um imunofenótipo comparável e diferenciação em adipose, osso e cartilagem (Lindroos et al., 2009; Patrikoski et al., 2013; Oikonomopoulos et al., 2015). O uso de mídia XF na expansão ASC resulta em ASCs perdendo sua capacidade de aderir ao plástico (Kyllonen et al., 2013; Patrikoski et al., 2013; Oikonomopoulos et al., 2015). São necessários agentes de revestimento adicionais para manter a característica inerente à aderência em plástico associada à ASC., O meio XF comercialmente disponível é caro e a preparação interna do meio XF pode ser demorada e pode aumentar o risco de variação lote-a-lote (Lund et al., 2009; Baer et al., 2010; Rajala et al., 2010; Yang et al., 2012; Kyllonen et al., 2013; Patrikoski et al., 2013; Oikonomopoulos et al., 2015).
alternativas humanas
alternativas humanas podem substituir meios suplementados FBS e SF / XF e podem criar um ambiente de cultura que se assemelha mais precisamente ao ambiente humano (Azouna et al., 2012; Koellensperger et al., 2014)., Além disso, a utilização de produtos autólogos (derivados do mesmo indivíduo) evita a necessidade de testes para agentes infecciosos e outros causadores de doenças.
soro humano
após ter sido permitido o coágulo no sangue total na ausência de um anticoagulante e ter sido centrifugado, o soro é a porção líquida resultante que não contém plaquetas, glóbulos brancos ou glóbulos vermelhos (Figura 1; Stedman, 2006). O soro humano (HS) pode ser autólogo (doador e receptor são os mesmos indivíduos) ou alogeneico (derivado de indivíduos que são diferentes do receptor)., Tanto autólogo quanto alogénico HS são superiores a FBS (Stute et al., 2004; Bieback et al., 2009, 2012; Bernardo et al., 2011; Kyllonen et al., 2013; Patrikoski et al., 2013). As ASCs expandidas no Sh têm maior estabilidade transcriptoma do que as expandidas no FBS, enquanto os genes responsáveis pelo prolongamento do ciclo celular, diferenciação e matriz extracelular e síntese de prostaglandinas são upregulados e sobreexpressos no FBS quando comparados com o HS usando a análise de microarray (Shahdadfar et al., 2005)., ASCs expandido em FBS alcançou senescence mais cedo e exibiu encurtamento telômero quando comparado com ASCs expandido em HS (Shahdadfar et al., 2005). A escolha do SH parece ter pouco efeito sobre as propriedades imunomodulatórias da ASCs. As asc expandiram-se em HS alogénicos ou em FBS contendo meios de comunicação com baixa imunogenicidade e resultaram na imunossupressão (Patrikoski et al., 2014). A ASCs expandiu-se em HS autólogo ou alogénico, apresentando maior proliferação e um imunofenótipo indistinguível quando comparado com a ASCs expandida em FBS (Josh et al., 2012; Bogdanova et al., 2014)., A ASCs expandida no HS alogeneico tem sido diferenciada em adipose, osso e cartilagem, embora a regulação dos genes condrogênicos e osteogênicos tenha sido favorecida em comparação com a FBS (Josh et al., 2012). A ASCs expandida em HS autólogo foram diferenciadas em adipose e cartilagem; no entanto, a capacidade de diferenciar em osso foi menos favorecida (Bogdanova et al., 2014). A HS autóloga pode proporcionar às ASC uma melhor proliferação e estabilidade genómica, determinadas pela análise de microarray quando comparadas com a HS alogénica (Shahdadfar et al., 2005; Bieback et al., 2009; Bernardo et al., 2011)., A ASCs expandiu-se no HS alogeneico entrou em paragem de crescimento e passou por morte celular (Shahdadfar et al., 2005; Lindroos et al., 2009), que limita as vantagens potenciais do HS alogeneico. Embora o HS autólogo possa ser ideal, a sua disponibilidade é limitada e pode haver uma variação significativa entre os doentes na capacidade do seu próprio soro para suportar o crescimento das suas próprias células (Lange et al., 2007). Alternativamente, o SH alogeneico pode ser agrupado, resultando em maiores quantidades para experimentação laboratorial e pode ser submetido a testes rigorosos de qualidade por um banco de sangue (por exemplo, o ALOGENEIC HS)., antes da utilização em seres humanos (Bieback et al., 2009).
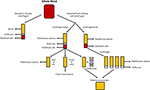
a Figura 1. Produção das diferentes alternativas humanas. O soro é produzido quando o sangue total pode coagular e centrifugar para sedimentar os glóbulos vermelhos e brancos e as plaquetas. O Plasma é produzido pela prevenção da coagulação seguida de centrifugação., Dependendo da velocidade de centrifugação, ou plasma pobre em plaquetas (PPP; centrifugação rápida) ou plasma rico em plaquetas (PRP; centrifugação mais lenta) é produzido. Se o PPP for armazenado a -18°C, é conhecido como plasma fresco congelado. Os concentrados de plaquetas podem ser produzidos tomando o plasma pobre em plaquetas e 4 camadas buffy e juntando – os ou centrifugando múltiplos PRP’s e agregando as esferas plaquetárias (suspensas em uma pequena quantidade de plasma) juntos.,o Plasma é a porção líquida não celular do sangue que contém água, electrólitos e proteínas (factores de coagulação, fibrinogénio e anticoagulantes). Plasma pobre de plaquetas (PPP), plasma fresco congelado (FFP) e plasma rico em plaquetas (PRP; Figura 1) pode ser obtido a partir do sangue total por centrifugação a diferentes velocidades, e subsequente armazenamento a diferentes temperaturas. A secreção de GF pode ser aumentada activando as plaquetas no sangue total com trombina antes da centrifugação (Doucet et al., 2005; Kocaoemer et al.,, 2007), aumentando assim a actividade dos produtos de plasma.
Plasma pobre em plaquetas
PPP está quase isento de plaquetas e é produzido a partir do sangue total pela adição de um anticoagulante durante o processo de colheita, após o qual o plasma é separado por centrifugação rápida (Figura 1; Koellensperger et al., 2006). Isto permite granular as plaquetas e os glóbulos vermelhos. O PPP resultante é armazenado a 4 ° C e é referido como plasma fresco., PDGF é secretado pelas plaquetas agregantes; no entanto, PDGF negligenciável é liberado em PPP como resultado do pequeno número de plaquetas residuais. As GFs podem, portanto, ter de ser adicionadas às PPP quando utilizadas nos meios de comunicação, como acontece quando se utiliza o meio SF (Müller et al., 2006; Gottipamula et al., 2013). A utilização de PPP sem a adição de GFs resultou em taxas de proliferação mais baixas e num aumento menor da síntese de ADN, medido utilizando a incorporação de timidina, quando comparado com o hs e o FBS (Vogel et al., 1980; Koellensperger et al., 2006)., O PPP com GFs adicionado resultou em aumento das taxas de proliferação em comparação com o HS (Koellensperger et al., 2006); no entanto, estas diferenças poderiam ter surgido de diferentes protocolos de produção de PPC e da adição de diferentes níveis de GFs a cada uma das preparações de PPC neste estudo. A expansão do ASCs em PPP resulta numa proliferação melhorada quando comparada com o FBS, e tem diferenciação osteogénica que é comparável à do ASCs expandido no HS (Koellensperger et al., 2014)., A diferenciação condrogénica diminuiu na ASCs expandida em PPP quando comparada com a ASCs expandida em PRP (Koellensperger et al., 2014).
Plasma fresco congelado
FFP é obtido da mesma forma que PPP, mas é congelado diretamente após separação a -18 ° C (O’Shaughnessy et al., 2004; Liumbruno et al., 2009). FFP tem sido usado na expansão de BM-MSCs com resultados positivos., Estes resultados incluem uma melhor proliferação, actividade imunossupressora e diferenciação em adipócitos e osteócitos; e um imunofenótipo e morfologia que é comparável às células expandidas na FBS (Müller et al., 2006; Mannello and Tonti, 2007). No entanto, a utilização de FFP como substituto sérico na expansão da ASC requer uma investigação mais aprofundada.
Plasma rico em plaquetas
PRP é a porção de sangue enriquecida em plaquetas. O PRP é produzido através da separação do plasma dos glóbulos vermelhos a velocidades de centrifugação mais lentas, o que impede a granulação das plaquetas (Figura 1)., A ASCs expandida no PRP mantém um imunofenótipo clássico e morfologia, e a PRP aumenta a proliferação quando comparada com a FBS (Kocaoemer et al., 2007; Chieregato et al., 2011; Atashi et al., 2015). A ASCs expandida na PRP melhorou a eficiência de diferenciação em direção a linhagens adipogênicas e osteogênicas, enquanto teve eficiência comparável para a diferenciação condrogênica, quando comparada com a ASCs expandida na FBS (Kocaoemer et al., 2007; Chieregato et al., 2011). Em comparação, verificou-se que o HS era ligeiramente melhor do que o PRP em termos de diferenciação e proliferação de ASCs (Kocaoemer et al.,, 2007; Chieregato et al., 2011). O PRP é um suplemento de meio de cultura mal definido devido à sua elevada variabilidade biológica e ao processo complicado de extracção, no qual pode ser difícil depurar o sobrenadante rico em factores plaquetários a partir de membranas plasmáticas. O uso de PRP é limitado pelas grandes quantidades de sangue total necessárias para produzir PRP suficiente para experimentação (Chieregato et al., 2011).,
Lisado de Plaquetas
lisado de plaquetas Humano (HPL) contém plaquetas GFs, que são obtidos através da lise de plaquetas concentrado em um pequeno volume de plasma (concentrados de plaquetas; Figura 1) por choque térmico. O HPL contém uma concentração mais elevada de GFs do que outros substitutos séricos, incluindo PRP e FBS humanos (Doucet et al., 2005; Bernardo et al., 2006, 2011; Bieback et al., 2009; Schallmoser et al., 2010)., A HPL pode ser facilmente obtida e produzida a partir de produtos de aférese e buffy coats, e pode ser ressuspendida em PRP ou uma solução aditiva (Schallmoser e Strunk, 2013; Iudicone et al., 2014). A HPL é produzida por congelação de plaquetas entre -30 e -80°C durante 24 h, seguida de uma fase de descongelação e centrifugação. Os ciclos repetidos de congelamento, degelo e centrifugação permitem a libertação de GFs e a remoção de corpos plaquetários (Bernardo et al., 2006; Schallmoser et al., 2007)., Outro benefício do suplemento HPL é que as plaquetas podem ser usadas após o prazo de validade de 4-5 dias de sangue banked (Bieback et al., 2009). O HPL é uma alternativa melhor do que o autólogo e o alogeneico HS, pois a ASCs expandiu-se no HPL mantendo seu imunofenótipo clássico, diferenciação, eficiência clonogênica, pureza celular e viabilidade celular (Trojahn Kølle et al., 2013; Riis et al., 2016). O HPL também suporta a expansão a longo prazo sem comprometer as propriedades imunomodulatórias da ASCs, medidas pela análise citométrica de fluxo (Bieback et al., 2009)., A expansão do HPL resulta em um menor tempo de duplicação da população, reduzindo o tempo necessário para a expansão celular e diminuindo a ameaça de senescência e transformação (Doucet et al., 2005; Shahdadfar et al., 2005; Bernardo et al., 2006, 2011; Azouna et al., 2012). A biossegurança do HPL foi avaliada usando hibridização genômica comparativa array e karyotipagem espectral de alta sensibilidade, onde se descobriu que a ASCs expandida no HPL não tinha aberrações cromossômicas (Crespo-diaz et al., 2011; Trojahn Kølle et al., 2013)., A morfologia ASC clássica (fina, menor, alongada e em forma de fuso) é mantida em HS e HPL, enquanto as ASCs expandidas em FBS são maiores e menos em forma de fuso (Trojahn Kølle et al., 2013). Embora isto possa indicar que tanto HS quanto HPL selecionam ASCs primitivas / imaturas (Doucet et al., 2005; Bieback et al., 2009), também sugere que as células cultivadas na FBS reduziram a proliferação e progrediram mais rapidamente em direção à senescência. HPL varia entre indivíduos (Bernardo et al., 2006; Crespo-diaz et al., 2011), e a variação lote-a-lote é reduzida quando o HPL é agrupado (Schallmoser et al.,, 2007; Trojahn Kølle et al., 2013). Além disso, ao reunir muitos doadores, é possível obter uma grande quantidade para suplementação, o que torna o HPL preferível ao PRP (Kocaoemer et al., 2007; Bieback et al., 2009; Chieregato et al., 2011).
conclusão
de acordo com Riis et al. de todos os ensaios clínicos registrados usando ASCs expandidas que listaram suas condições de expansão, a maioria faz uso de FBS, três ensaios usam HS autólogo, um ensaio usa PRP, e um ensaio usa HPL (Riis et al., 2015)., Estas Estatísticas são alarmantes, uma vez que a FBS tem potencial para transmitir doenças zoonóticas após o transplante de células, e foram notificadas reacções imunitárias contra os Componentes da FBS (Selvaggi et al., 1997; Mackensen et al., 2000). A FBS é um produto não conforme com a GMP, uma vez que afecta a segurança e a eficácia do medicamento ASC, pelo que necessita de ser substituído (van der Valk et al., 2004; Kyllonen et al., 2013; Witzeneder et al., 2013). Isto foi remediado através da substituição de FBS por alternativas derivadas humanas quimicamente definidas., A mudança de FBS para alternativas humanas ou meios XF/SF em medicina regenerativa tem a vantagem importante de que a ASCs prolifere muito mais rapidamente neste último, resultando em um maior número de células para transplantação em um tempo mais curto. No entanto, a superioridade relativa de diferentes meios de cultura ainda é amplamente debatida. Estudos que compararam mais de um meio de cultura relataram resultados variáveis (Lange et al., 2007; Bernardo et al., 2011; Koellensperger et al., 2014; Riis et al., 2016). Koellensperger et al., comparou a diferenciação de trilineagem de ASCs expandida em FBS, PRP, PPP, e HS (Koellensperger et al., 2014). Seus resultados revelaram que cada meio de cultura permitiu a diferenciação em uma ou mais linhagens, mas nunca em todas as três linhagens. Quando a XF media, a FBS e a HPL suplemented media foram comparadas, Riis et al. descobriu-se que certas subpopulações expressavam marcadores de superfície específicos dependendo do meio de cultura utilizado (Riis et al., 2016)., Estudos comparando o imunofenótipo da ASCs expandido em FBS e outros meios de cultura, encontraram pouca ou nenhuma diferença na expressão do marcador de superfície celular, independentemente dos marcadores estudados (Tabela 1). Densidade de semeadura, tensão de oxigênio, confluência, dissociação, e a escolha dos meios basais também podem influenciar os resultados experimentais (Sotiropoulou et al., 2006; Freshney, 2010; Bourin et al., 2013; Inamdar e Inamdar, 2013; Feng et al., 2014; Riis et al., 2015)., A escolha do meio de cultura depende da aplicação a jusante destas células (administração de ASC diferenciadas ou não diferenciadas) e da condição a ser tratada. Adicionalmente, a imunogenicidade do meio de cultura utilizado para expandir as células antes da aplicação clínica deve ser considerada como um parâmetro que pode influenciar o resultado clínico. A maioria dos estudos comparando diferentes meios de cultura usou os critérios especificados pelo ISCT e IFATS para validar o uso de uma alternativa ao FBS., A maioria destes estudos examina morfologia ASC, proliferação, imunofenótipo, e a capacidade destas células para diferenciar ao longo de linhagens osteogênicas, condrogênicas e adipogênicas em diferentes meios de cultura. Poucos estudos exploraram outros aspectos da ASCs, tais como senescência, estabilidade genética, transcriptoma, proteoma, imunogenicidade, secreção de citocinas e ciclo celular (Shahdadfar et al., 2005; Bieback et al., 2012). Enquanto os critérios ISCT e IFATS foram uma tentativa de unificar o campo em termos de procedimentos operacionais padrão (Dominici et al., 2006; Bourin et al.,, 2013), não existe consenso sobre quais propriedades da ASCs são relevantes para ensaios clínicos, tornando a comparação de diferentes meios de cultura virtualmente impossível. Embora estes critérios proporcionem resultados mensuráveis para uma comparação fácil, a alteração dos componentes utilizados para a expansão das ASCs pode ter efeitos diferentes na segurança, eficácia e reprodutibilidade dos produtos finais da ASC. Examinar as alterações na transcriptoma, proteoma e secretome da ASCs expandidas em vários meios de cultura é importante, assim como o uso de células expandidas sob diferentes condições em modelos pré-clínicos apropriados.,
Tabela 1. The effects of the different media suplementos on ASCs in vitro.
contribuições dos autores
CD conceptualizou e redigiu a revisão, e aprovou o manuscrito final. MP ajudou na conceptualização da revisão, revisou e aprovou o manuscrito final. A MSP ajudou na conceptualização da revisão, editou e aprovou o manuscrito final, e aumentou o financiamento para os projetos em causa. Todos os autores leram e aprovaram o manuscrito final.,esta investigação e a sua publicação são o resultado do financiamento fornecido pelo Conselho de Investigação Médica da África do Sul em termos do projecto SAMRC-RFA-UFSP-01-2013/células estaminais, bem como (b) A Unidade Extramural para pesquisa e terapia de células estaminais. A Fundação Nacional de pesquisa da África do Sul também forneceu financiamento.
Declaração de conflito de interesses
os autores declaram que a investigação foi realizada na ausência de quaisquer relações comerciais ou financeiras que possam ser interpretadas como um potencial conflito de interesses.,
agradecimentos
os autores gostariam de agradecer à Dra. Cheryl Tosh pela sua assistência editorial.Chieregato, K., Castegnaro, S., Madeo, D., Astori, G., Pegoraro, M., and Rodeghiero, F. (2011). O factor de crescimento epidérmico, o factor de crescimento básico dos fibroblastos e o factor de crescimento derivado das plaquetas-bb podem substituir o soro fetal bovino e competir com o plasma rico em plaquetas humano na expansão ex vivo das células estromais mesenquimais derivadas do tecido adiposo. Citotherapy 13, 933-943. doi: 10.3109 / 14653249.2011.,583232
PubMed Abstract | CrossRef Full Text | Google Scholar
Mannello, F., And Tonti, G. (2007). Revisão concisa: não há avanços para a cultura de células estaminais mesenquimais e embrionárias humanas: meio condicionado, camada alimentadora ou sem alimentador; meio com soro fetal de vitelo, soro humano ou plasma enriquecido; meio não conditionado sem soro, substituto do soro, ou fórmula ad hoc? tudo o que brilha não é ouro! Células Estaminais 25, 1603-1609. doi: 10.1634/caule.2007-0127
PubMed Abstract | CrossRef Full Text | Google Scholar
Selvaggi, T. A., Walker, R. E.,), e Fleisher, T. A. (1997). Desenvolvimento de anticorpos ao soro do feto de vitelo com reacções do tipo artho em doentes infectados pelo vírus da imunodeficiência humana, aos quais foram administradas perfusões de linfócitos syngeneicos. Sangue 89, 776-779.
PubMed Abstract/Google Scholar
Stedman, T. L. (2006). Stedman’s Medical Dictionary. Philadelphia, PA: Lippincott Williams & Wilkins.
Google Scholar