Rutherford em Manchester, 1907-1919
Ernest Rutherford descobriu o núcleo do átomo, em 1911. Nós lemos isso em livros didáticos e em escritos populares. Mas o que significa essa Declaração? A descoberta geográfica geralmente significa que se vê um lugar pela primeira vez. Mas a descoberta pode ser a mesma para um reino escondido da vista? Não se pode ver um átomo nesse sentido., Então isso sugere que talvez a história da descoberta do núcleo fosse mais complicada. A história como se desenrolou no laboratório de Rutherford na Universidade de Manchester girava em torno de pessoas reais. Envolvia frustrações e triunfos. Envolveu trabalho duro, perplexidade e inspiração.
 When Rutherford became professor at Manchester in 1907, he found modern labs for both teaching and research. A pedido de seu antecessor, Arthur Schuster, mais de 40 mil libras foram levantadas para dotar o programa de física. Para comparação, o generoso salário de Rutherford era £1.600 / ano., Credit: From the book: the physical laboratories of the University of Manchester: a record of 25 years ‘ work by the University of Manchester, Manchester: At the University Press, 1906. AIP Emilio Segrè Visual Archives, Brittle Books Collection.Rutherford chegou a Manchester no verão de 1907, meses antes do início do mandato da Universidade. Foi nomeado Professor de Física Langworthy, sucessor de Arthur Schuster (1851-1934), que se aposentou aos 56 anos para recrutar Rutherford. Schuster construiu um edifício de física moderna, contratou Hans Geiger, Ph. D., (1882-1945) because of his experimental skill, and endowed a new position in mathematical physics to round out a full physics program. Rutherford entrou no centro do mundo da física. Os investigadores vieram ter com ele às dúzias.Rutherford chegou com muitas questões de pesquisa em mente. Ele não foi feito com os quebra-cabeças das famílias de decaimento de tório, rádio, etc., mas ele estava passando grande parte deste trabalho para Boltwood, Hahn, e Soddy. Boltwood e Hahn trabalharam com Rutherford em Manchester, Boltwood em 1909-1910 e Hahn em 1907-1908., Rutherford estava gradualmente voltando sua atenção muito mais para os raios α (Alfa), β (beta) e γ (gama) e para o que eles poderiam revelar sobre o átomo. Ou seja, ele estava deixando Radio-química para os outros e voltando-se para a física.
When Rutherford became professor at Manchester in 1907, he found modern labs for both teaching and research. A pedido de seu antecessor, Arthur Schuster, mais de 40 mil libras foram levantadas para dotar o programa de física. Para comparação, o generoso salário de Rutherford era £1.600 / ano., Credit: From the book: the physical laboratories of the University of Manchester: a record of 25 years ‘ work by the University of Manchester, Manchester: At the University Press, 1906. AIP Emilio Segrè Visual Archives, Brittle Books Collection.Rutherford chegou a Manchester no verão de 1907, meses antes do início do mandato da Universidade. Foi nomeado Professor de Física Langworthy, sucessor de Arthur Schuster (1851-1934), que se aposentou aos 56 anos para recrutar Rutherford. Schuster construiu um edifício de física moderna, contratou Hans Geiger, Ph. D., (1882-1945) because of his experimental skill, and endowed a new position in mathematical physics to round out a full physics program. Rutherford entrou no centro do mundo da física. Os investigadores vieram ter com ele às dúzias.Rutherford chegou com muitas questões de pesquisa em mente. Ele não foi feito com os quebra-cabeças das famílias de decaimento de tório, rádio, etc., mas ele estava passando grande parte deste trabalho para Boltwood, Hahn, e Soddy. Boltwood e Hahn trabalharam com Rutherford em Manchester, Boltwood em 1909-1910 e Hahn em 1907-1908., Rutherford estava gradualmente voltando sua atenção muito mais para os raios α (Alfa), β (beta) e γ (gama) e para o que eles poderiam revelar sobre o átomo. Ou seja, ele estava deixando Radio-química para os outros e voltando-se para a física. Rutherford sempre reuniu um grupo de jovens pesquisadores brilhantes ao seu redor. Nesta foto de grupo de 1910 estão Ernest Marsden e Hans Geiger. Front and center são professores Schuster e Rutherford, e centrado na retaguarda está William Kay, o talentoso e útil administrador do laboratório. Crédito: J. B. Birks, ed.,, Rutherford at Manchester (London: Heywood & Co., 1962), opposite p. 38. a equipe inicial de Rutherford em Manchester incluía Geiger e William Kay( 1879-1961), Assistente de laboratório Júnior desde 1894. Rutherford promoveu Kay para o laboratório steward em 1908, para gerenciar equipamentos de laboratório e ajudá-lo em sua pesquisa. Em 1957, Kay pensou em sua juventude com Rutherford em uma entrevista. A linguagem é pitoresca, mas a descrição é tão próxima da abordagem de Rutherford quanto nós conseguimos., O questionador foi Samuel Devons (1914-2006), que foi um dos últimos estudantes de Rutherford na década de 1930.
Rutherford sempre reuniu um grupo de jovens pesquisadores brilhantes ao seu redor. Nesta foto de grupo de 1910 estão Ernest Marsden e Hans Geiger. Front and center são professores Schuster e Rutherford, e centrado na retaguarda está William Kay, o talentoso e útil administrador do laboratório. Crédito: J. B. Birks, ed.,, Rutherford at Manchester (London: Heywood & Co., 1962), opposite p. 38. a equipe inicial de Rutherford em Manchester incluía Geiger e William Kay( 1879-1961), Assistente de laboratório Júnior desde 1894. Rutherford promoveu Kay para o laboratório steward em 1908, para gerenciar equipamentos de laboratório e ajudá-lo em sua pesquisa. Em 1957, Kay pensou em sua juventude com Rutherford em uma entrevista. A linguagem é pitoresca, mas a descrição é tão próxima da abordagem de Rutherford quanto nós conseguimos., O questionador foi Samuel Devons (1914-2006), que foi um dos últimos estudantes de Rutherford na década de 1930.
 Hans Geiger foi o principal parceiro de Rutherford na pesquisa de raios alfa de 1907 a 1913. Juntos eles desenvolveram várias maneiras de detectar raios alfa. Provaram que os raios alfa são núcleos de hélio duplamente ionizados. Certificacao. 1908. Crédito: AIP Emilio Segre Visual Archives, Physics Today Collection.Rutherford and Hans Geiger worked closely in 1907 and 1908 on the detection and measurement of α particles., Se eles usassem partículas α para sondar o átomo, eles tinham primeiro que saber mais sobre essas partículas e seu comportamento. Rutherford tentou e falhou em McGill para contar partículas α.um ano depois, em Manchester, ele e Geiger conseguiram dois métodos de observação de partículas α. O primeiro método envolveu cintilações excitadas por partículas α EM UMA fina camada de sulfeto de zinco. Observavam-nos através de um microscópio e contavam as cintilações em diferentes ângulos de dispersão., Eles também desenvolveram um “eletrômetro” que poderia demonstrar a passagem de uma partícula α individual para um grande público. O instrumento, que evoluiu para o” contador Geiger”, tinha um cilindro de metal parcialmente evacuado com um fio no centro. Eles aplicaram uma voltagem entre o cilindro e o fio alto o suficiente para acender. Eles admitiram partículas α através de uma janela mica fina, onde estas partículas colidiram com gases, produzindo íons de gás. Estes colidiram com outras moléculas e produziram mais íons, e assim por diante., Cada partícula α produzia uma cascata de íons, que descarregava parcialmente o cilindro e indicava a passagem de uma partícula α. Geiger and Rutherford published several articles in 1908 and 1909 on these methods and their use.
Hans Geiger foi o principal parceiro de Rutherford na pesquisa de raios alfa de 1907 a 1913. Juntos eles desenvolveram várias maneiras de detectar raios alfa. Provaram que os raios alfa são núcleos de hélio duplamente ionizados. Certificacao. 1908. Crédito: AIP Emilio Segre Visual Archives, Physics Today Collection.Rutherford and Hans Geiger worked closely in 1907 and 1908 on the detection and measurement of α particles., Se eles usassem partículas α para sondar o átomo, eles tinham primeiro que saber mais sobre essas partículas e seu comportamento. Rutherford tentou e falhou em McGill para contar partículas α.um ano depois, em Manchester, ele e Geiger conseguiram dois métodos de observação de partículas α. O primeiro método envolveu cintilações excitadas por partículas α EM UMA fina camada de sulfeto de zinco. Observavam-nos através de um microscópio e contavam as cintilações em diferentes ângulos de dispersão., Eles também desenvolveram um “eletrômetro” que poderia demonstrar a passagem de uma partícula α individual para um grande público. O instrumento, que evoluiu para o” contador Geiger”, tinha um cilindro de metal parcialmente evacuado com um fio no centro. Eles aplicaram uma voltagem entre o cilindro e o fio alto o suficiente para acender. Eles admitiram partículas α através de uma janela mica fina, onde estas partículas colidiram com gases, produzindo íons de gás. Estes colidiram com outras moléculas e produziram mais íons, e assim por diante., Cada partícula α produzia uma cascata de íons, que descarregava parcialmente o cilindro e indicava a passagem de uma partícula α. Geiger and Rutherford published several articles in 1908 and 1909 on these methods and their use.
Rutherford wrote to Henry Bumstead (1870-1920), an American physicist, on 11 July 1908:
Geiger is a good man and worked like a slave. Nunca teria arranjado tempo para o trabalho árduo antes de termos as coisas a correr em bom estilo. Finalmente tudo correu bem, mas a dispersão é o diabo. O nosso tubo funcionou como um amuleto e podemos facilmente ter um lançamento de 50 mm., para cada partícula. … Geiger é um demônio no trabalho de contar cintilações e poderia contar em intervalos de uma noite inteira sem perturbar sua equanimidade. Condenei vigorosamente e retirei-me depois de dois minutos. (Citado em Eva, p. 180.)
embora Rutherford suspeitasse já em 1906 que as partículas α eram átomos de hélio despojados de seus elétrons, ele exigiu um alto padrão de prova. Um tipo de experiência não era suficiente. Um tipo de detector não era suficiente. Ele queria mais provas., Para isso, Rutherford desejava “grandes voltagens” e eletromagnetos grandes para desviar partículas α, mas este método ainda não estava maduro. Laboratório de mordomo William Kay recordou na citada entrevista de história oral que Rutherford, em 1908, insistiu que os fortes campos elétricos e magnéticos eram necessários para medir com mais diretamente a carga e a massa de α e β partículas:
Kay disse Rutherford queriam um grande, água-de refrigeração do ímã, mas que ele “deixou-a cair, como um bolo quente” quando soube do seu custo. Então ele precisava de uma nova linha de ataque. A nova linha era muito simples, um procedimento químico misturado com a física., Para este trabalho Rutherford recrutou Thomas Royds (1884-1955), que ganhou seu diploma de Física em 1906. Recolheram partículas α num tubo de vidro selado, comprimiram-NAS e passaram por uma faísca Eléctrica. Eles estudaram a luz emitida em um espectroscópio e descobriram que ela era idêntica ao espectro do hélio. Em poucos meses, Rutherford foi premiado com o Prêmio Nobel de química, “por suas investigações sobre a desintegração dos elementos, e a química das substâncias radioativas.,”(Nobel citation) Rutherford and Royds had established the identity and primary properties of α particles. Rutherford virou sua atenção para usá-los para sondar o átomo.
O Outono de 1908 começou uma importante série de pesquisas. Geiger tinha passado feixes de partículas α através de ouro e outras folhas metálicas, usando as novas técnicas de detecção para medir o quanto esses feixes foram dispersos pelos átomos nas folhas. Geiger pensou que Ernest Marsden (1889-1970), um estudante de 19 anos em física de honras, estava pronto para ajudar nessas experiências e sugeriu-o a Rutherford., Uma vez que Rutherford muitas vezes empurrou estudantes do terceiro ano para a pesquisa, dizendo que esta era a melhor maneira de aprender sobre física, ele prontamente concordou.
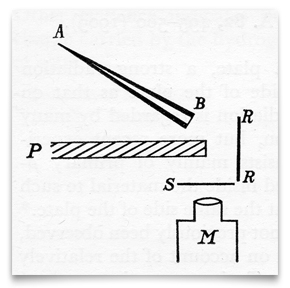 este esboço, do artigo de Geiger e Marsden de 1909, mostra um tubo de vidro cónico cheio de “emanação de rádio” (radon), fechado em B com uma fina camada de mica. Esta era a sua fonte de partículas alfa (α). S era uma tela de sulfeto de zinco, que cintilava quando atingida por uma partícula α. P era uma tela de chumbo, que bloqueou qualquer partículas α de viajar diretamente para a tela de sulfeto de zinco., RR era uma folha (ou folhas) de diferentes metais (incluindo ouro) que” refletia difusamente ” partículas α incidentes. Geiger and Marsden observed the resulting scintillations through an observing microscope, M. Credit: H. Geiger and E. Marsden, “On a Diffuse Reflection of The α-Particles,” Proceedings of the Royal Society,1909, 82:495-500.
este esboço, do artigo de Geiger e Marsden de 1909, mostra um tubo de vidro cónico cheio de “emanação de rádio” (radon), fechado em B com uma fina camada de mica. Esta era a sua fonte de partículas alfa (α). S era uma tela de sulfeto de zinco, que cintilava quando atingida por uma partícula α. P era uma tela de chumbo, que bloqueou qualquer partículas α de viajar diretamente para a tela de sulfeto de zinco., RR era uma folha (ou folhas) de diferentes metais (incluindo ouro) que” refletia difusamente ” partículas α incidentes. Geiger and Marsden observed the resulting scintillations through an observing microscope, M. Credit: H. Geiger and E. Marsden, “On a Diffuse Reflection of The α-Particles,” Proceedings of the Royal Society,1909, 82:495-500.
Geiger e Marsden começou com pequeno-ângulo de dispersão e tentou de várias espessuras de chapas, buscando relações matemáticas entre a dispersão e a espessura da folha ou número de átomos percorrido., Marsden mais tarde lembrou que Rutherford disse a ele em meio a esses experimentos: “veja se você pode obter algum efeito de partículas alfa refletidas diretamente de uma superfície de metal.”(Reported by Marsden in Birks, 1962, p. 8). Marsden duvidou de que Rutherford esperado de volta dispersão de partículas α, mas como Marsden escreveu
…foi um daqueles ‘palpites’ que, talvez, algum efeito pode ser observado, e que em qualquer caso em que o território vizinho deste Tom Tiddler do solo pode ser explorado por reconhecimento., Rutherford estava sempre pronto para encontrar o inesperado e explorá-lo, onde favorável, mas ele também sabia quando parar em tais excursões. (Birks, 1962, p. 8)
This was Rutherford’s playful approach in action. Seus alunos e outros testaram suas ideias, muitas das quais eram becos sem saída. No entanto, esta ideia de procurar a dispersão de partículas α valeu a pena., Rutherford escreveu:
Experimento, dirigido por disciplinado imaginação de uma pessoa ou, ainda melhor, de um grupo de indivíduos de variadas mental outlook, é capaz de alcançar resultados que transcendem em muito a imaginação sozinho o maior filósofo. (Citado em Eve, 1939, Frontmatter)
algum tempo mais tarde em 1908 ou 1909, Marsden disse, ele relatou seus resultados para Rutherford. Rutherford lembrou isso um pouco diferente: eu me lembro …mais tarde Geiger veio até mim em grande excitação e disse: “Nós fomos capazes de obter algumas das partículas α voltando para trás…, Foi o evento mais incrível que já me aconteceu na minha vida. Foi quase incrível como se tivesses disparado uma concha de 15 polegadas num pedaço de papel de papel e ele voltou e bateu-te. (Rutherford, 1938, p. 68)
a memória humana é falível. Se Marsden ou Geiger disseram a Rutherford, o efeito foi o mesmo. Rutherford disse que eles deveriam preparar uma publicação desta pesquisa, que eles apresentaram em maio de 1909. Além disso, isso começou Rutherford pensando sobre o que, em última análise, quase dois anos depois, ele publicou como uma teoria do átomo.,o que fez Rutherford durante o resto de 1909 e todo o 1910? Por um lado, o seu amigo Boltwood esteve em Manchester durante o ano lectivo a trabalhar com Rutherford em produtos de decaimento radioactivo de rádio. Ele também estava revendo e falando sobre idéias anteriores sobre a estrutura atômica. Mais importante, ele estava levando o fenômeno do espalhamento de partículas α de forma sistemática e testando cada peça. Rutherford não teve sua idéia ousada — o átomo nuclear — instantaneamente, mas ele chegou a ele gradualmente, considerando o problema de muitos lados.,no outono de 1910 ele trouxe Marsden de volta a Manchester para completar testes experimentais rigorosos de suas ideias com Geiger. Restabeleceram as taxas de emissão e as gamas de partículas α Por fontes radioactivas e reexaminaram as suas análises estatísticas. Rutherford tentou conciliar resultados de dispersão com diferentes modelos atômicos, especialmente o de J. J. Thomson, no qual a eletricidade positiva foi considerada como dispersa uniformemente por toda a esfera do átomo.
 a page of Rutherford’s early, undated (1910 ou 1911), rough notes., As primeiras linhas dizem: “teoria da estrutura do átomo. Suponha que o átomo consiste de + carga ne no centro & de – carga como elétron distribuído em toda a esfera de raio R.” Ele então esboçou ideias sobre o cálculo da força de deflexão em uma partícula carregada passando perto deste centro carregado. Crédito: J. B. Birks, ed., Rutherford at Manchester (London: Heywood & Co., 1962), p. 70.em algum ponto do inverno de 1910-1911, Rutherford desenvolveu a ideia básica de um átomo com um “centro carregado”.,”Como Geiger e Marsden apontaram em seu artigo de 1909:
a page of Rutherford’s early, undated (1910 ou 1911), rough notes., As primeiras linhas dizem: “teoria da estrutura do átomo. Suponha que o átomo consiste de + carga ne no centro & de – carga como elétron distribuído em toda a esfera de raio R.” Ele então esboçou ideias sobre o cálculo da força de deflexão em uma partícula carregada passando perto deste centro carregado. Crédito: J. B. Birks, ed., Rutherford at Manchester (London: Heywood & Co., 1962), p. 70.em algum ponto do inverno de 1910-1911, Rutherford desenvolveu a ideia básica de um átomo com um “centro carregado”.,”Como Geiger e Marsden apontaram em seu artigo de 1909:
Se a alta velocidade e massa da partícula-α for tida em conta, parece surpreendente que algumas das partículas-α, como mostra o experimento, possam ser rodadas dentro de uma camada de 6 x 10-5 cm. de ouro através de um ângulo de 90°, e ainda mais. Para produzir um efeito semelhante por um campo magnético, seria necessário o enorme campo de 109 unidades absolutas. (Birks, p., 179)
Rutherford concluiu em seu Maio de 1911 papel que tal um notável desvio no caminho de uma grande partícula carregada que só poderia ser alcançado se a maior parte da massa de um átomo de ouro e a maioria de seus responsáveis foram concentrados em uma pequena central do corpo. Nota: neste ponto, em 1911, Rutherford não chamou isso de “núcleo”.
você precisa Flash Player instalado para ouvir este clipe de áudio.,
O primeiro anúncio público da teoria nuclear por Rutherford foi feito em uma reunião da Sociedade Literária e filosófica de Manchester, e ele nos convidou jovens meninos para ir para a reunião. Ele disse que tinha coisas interessantes para dizer e achou que gostávamos de ouvi-las. Não sabíamos do que se tratava naquela altura. As pessoas mais velhas do laboratório sabiam, é claro, que Geiger e Marsden sabiam porque já estavam fazendo as experiências. Na verdade, a menos que tivessem feito alguns que fossem suficientes para serem decisivos, Rutherford nunca o mencionou publicamente., E, claro, Darwin sabia disso muito antes. Mas isso deve ter sido no início de 1911, e fomos à reunião e ele disse-nos. E ele mencionou então que havia algumas evidências experimentais que tinham sido obtidas por Geiger e Marsden. Tanto quanto me lembro, não disse mais sobre os resultados do que sobre os que foram bastante decisivos. E, como eu disse antes, ele nunca teria feito um anúncio público desse tipo se não tivesse boas provas., E essa é uma das características que percorre todo o trabalho de Rutherford, particularmente todo o seu trabalho até ao final do período de Manchester. Se você olhar para alguns dos seus artigos nos primeiros dias, eu chamo de McGill primeiros dias ele estava bastante convencido de que as partículas alfa eram átomos de hélio, mas ele nunca disse que aquelas palavras. Ele sempre disse que eram átomos de hélio ou moléculas de hidrogênio ou talvez ele possa ter dito algo mais desse peso., Era bastante característico dele que ele nunca diria que algo era assim, a menos que ele tivesse provas experimentais para isso que realmente o satisfizesse.
na verdade, Rutherford foi extremamente cauteloso em tirar conclusões sobre esta carga central: “um cálculo simples mostra que o átomo deve ser um assento de um campo elétrico intenso, a fim de produzir uma deflexão tão grande em um único encontro.”(Birks, p. 183). He worked out quickly and roughly that several quantitative relationships should be true if this basic theory were correct., Em primeiro lugar, o número de partículas α dispersas através de um dado ângulo deve ser proporcional à espessura da folha. Em segundo lugar, esse número deve ser proporcional ao quadrado da carga nuclear. Finalmente, deve ser inversamente proporcional à quarta potência da velocidade da partícula α. Estas três ideias expuseram o programa experimental de Geiger e Marsden para o próximo ano.
você precisa Flash Player instalado para ouvir este clipe de áudio.,
O interesse de Rutherford foi então quase inteiramente na pesquisa. Ele tinha feito muito pouco ensino em McGill. Era professor de pesquisa. Suponho que ele deu algumas palestras, mas teria sido muito poucas. E o interesse dele era muito natural no lado da pesquisa. Ele deu algumas palestras, mas palestras elementares, o tipo de coisa que se esperaria que um homem soubesse antes de vir para a Universidade. Eram as palestras para os engenheiros. Eram muito desordeiros e Rutherford podia mantê-los sob controlo., Havia talvez apenas um outro homem no departamento que poderia tê-lo feito, e ele (Rutherford?) apreciou – os porque ele foi capaz de mostrar-lhes as experiências muito interessantes que se pode realizar em cursos elementares.foi-me frequentemente dito que Rutherford era um mau professor. Nunca ouvi tal disparate. É verdade que, por vezes, ele seria um pouco aborrecido, um pouco confuso, mas isso foi apenas em ocasiões muito raras. Houve outras ocasiões em que ele era muito estimulante. Havia um enorme entusiasmo nele.,
Rutherford entreteve a possibilidade de que o centro carregado é negativo. Isso parece estranho hoje, então o que o tornou razoável? Primeiro, não era muito diferente do modelo do Thomson. Em segundo lugar, como Rutherford sabia que as partículas α carregam uma carga + dupla, ele pensou que isso poderia agir da mesma forma que o sol faz em um cometa que varre perto dele. Ele iria lançar a partícula α Ao redor e de volta para a sua fonte. He also considered a nearly forgotten model suggested by Japanese physicist Hantaro Nagaoka (1865-1950) — the Saturnian model., Nagaoka e Rutherford estavam em contato em 1910 e 1911 e Rutherford mencionou o modelo de Nagaoka de “uma massa central atraindo anéis de elétrons rotativos” (Birks, p. 203). O resultado final neste artigo crítico de Rutherford, no entanto, foi o anúncio de Rutherford de que se o átomo fosse um disco ou uma esfera, e de fato se a carga central fosse positiva ou negativa, não afetaria os cálculos. Rutherford sempre teve o cuidado de não reivindicar mais do que seus resultados poderiam suportar.,
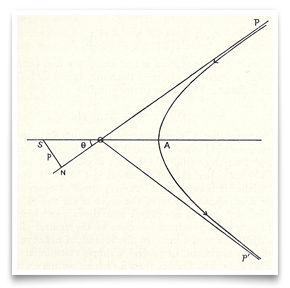 In Rutherford’s now-famous paper of May 1911 on the scattering of alpha particles by gold foil, he included this sketch of the hyperbolic path of a particle. Credit: E. Rutherford,” The Scattering of α and β Particles by Matter and the Structure of Matter, ” Philosophical Magazine, 1911, 21:669-688.Rutherford viu possíveis testes da natureza da carga central. A absorção de partículas β, disse ele, deve ser diferente com um centro negativo versus um positivo., Um centro positivo explicaria a grande velocidade que as partículas α atingem durante a emissão de elementos radioativos. Mas estas eram apenas pistas.
In Rutherford’s now-famous paper of May 1911 on the scattering of alpha particles by gold foil, he included this sketch of the hyperbolic path of a particle. Credit: E. Rutherford,” The Scattering of α and β Particles by Matter and the Structure of Matter, ” Philosophical Magazine, 1911, 21:669-688.Rutherford viu possíveis testes da natureza da carga central. A absorção de partículas β, disse ele, deve ser diferente com um centro negativo versus um positivo., Um centro positivo explicaria a grande velocidade que as partículas α atingem durante a emissão de elementos radioativos. Mas estas eram apenas pistas. 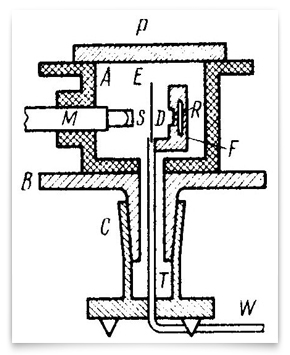 este esquema representa os experimentos refinados de 1912-13 realizados por Geiger e Marsden. R era a fonte de partículas alfa, e era a folha de ouro, E M era o microscópio rotável em torno de um eixo vertical centrado na folha de ouro. Partículas alfa da fonte que passaram pelo diafragma D, foram dispersas pela folha, e foram observadas como cintilações na tela S., Geiger e Marsden observaram os ângulos de partículas dispersas girando o conjunto microscópico. Credit: H. Geiger and E. Marsden,” The Laws of Deflexion of α Particles through Large Angles, ” Philosophical Magazine, 1913, 25:604-623.Geiger e Marsden realmente trabalharam sistematicamente através das implicações testáveis da hipótese da carga central de Rutherford. A primeira grande publicação de seus resultados foi em alemão nos trabalhos da Academia de Ciências de Viena (Sitzungberichte der Wiener Akademie der Wissenschaften) em 1912., Esta versão de 30 páginas foi seguida por uma em inglês em 1913 na revista filosófica: “The Laws of Deflexion of α Particles through Large Angles” a versão em inglês é a mais conhecida. Ligeiras diferenças entre os dois levaram um historiador a sugerir que Rutherford decidiu a favor de um centro positivamente carregado em agosto de 1912 (Trenn, 1974). Rutherford outros membros da equipe, especialmente Charles Galton Darwin (1887-1962), H. G. J. Moseley (1887-1915) e Niels Bohr (1885-1962) figuram no final estabelecimento de Rutherford nuclear do átomo.,
este esquema representa os experimentos refinados de 1912-13 realizados por Geiger e Marsden. R era a fonte de partículas alfa, e era a folha de ouro, E M era o microscópio rotável em torno de um eixo vertical centrado na folha de ouro. Partículas alfa da fonte que passaram pelo diafragma D, foram dispersas pela folha, e foram observadas como cintilações na tela S., Geiger e Marsden observaram os ângulos de partículas dispersas girando o conjunto microscópico. Credit: H. Geiger and E. Marsden,” The Laws of Deflexion of α Particles through Large Angles, ” Philosophical Magazine, 1913, 25:604-623.Geiger e Marsden realmente trabalharam sistematicamente através das implicações testáveis da hipótese da carga central de Rutherford. A primeira grande publicação de seus resultados foi em alemão nos trabalhos da Academia de Ciências de Viena (Sitzungberichte der Wiener Akademie der Wissenschaften) em 1912., Esta versão de 30 páginas foi seguida por uma em inglês em 1913 na revista filosófica: “The Laws of Deflexion of α Particles through Large Angles” a versão em inglês é a mais conhecida. Ligeiras diferenças entre os dois levaram um historiador a sugerir que Rutherford decidiu a favor de um centro positivamente carregado em agosto de 1912 (Trenn, 1974). Rutherford outros membros da equipe, especialmente Charles Galton Darwin (1887-1962), H. G. J. Moseley (1887-1915) e Niels Bohr (1885-1962) figuram no final estabelecimento de Rutherford nuclear do átomo., the young Henry G. J. Moseley, in the Balliol-Trinity Laboratory, Oxford, ca. 1910. Mais tarde naquele ano, Moseley começou a pesquisa no Laboratório de Rutherford em Manchester. Sua brilhante carreira foi interrompida em combate na Primeira Guerra Mundial.crédito: Universidade de Oxford, Museu de História da ciência, cortesia AIP Emilio Segrè Visual Archives, Physics Today Collection.a “Grande Guerra” interrompeu totalmente o trabalho no departamento de Manchester de Rutherford. Bohr voltou para a Dinamarca. Marsden aceitou uma cátedra na Nova Zelândia. Moseley morreu na batalha de Gallipoli., James Chadwick (1891-1974), que estava trabalhando com Geiger na Universidade Técnica de Berlim quando a guerra eclodiu, passou vários anos internado no campo Ruhleben para prisioneiros de guerra. Outros estudantes foram para a guerra, também, e Rutherford dedicou considerável energia para mobilizar a ciência para o esforço de guerra e especificamente para técnicas anti-submarinas.
the young Henry G. J. Moseley, in the Balliol-Trinity Laboratory, Oxford, ca. 1910. Mais tarde naquele ano, Moseley começou a pesquisa no Laboratório de Rutherford em Manchester. Sua brilhante carreira foi interrompida em combate na Primeira Guerra Mundial.crédito: Universidade de Oxford, Museu de História da ciência, cortesia AIP Emilio Segrè Visual Archives, Physics Today Collection.a “Grande Guerra” interrompeu totalmente o trabalho no departamento de Manchester de Rutherford. Bohr voltou para a Dinamarca. Marsden aceitou uma cátedra na Nova Zelândia. Moseley morreu na batalha de Gallipoli., James Chadwick (1891-1974), que estava trabalhando com Geiger na Universidade Técnica de Berlim quando a guerra eclodiu, passou vários anos internado no campo Ruhleben para prisioneiros de guerra. Outros estudantes foram para a guerra, também, e Rutherford dedicou considerável energia para mobilizar a ciência para o esforço de guerra e especificamente para técnicas anti-submarinas. Niels Bohr trabalhou pela primeira vez com Rutherford em Manchester em 1912. Esta foto mostra os jovens Niels e Margrethe Bohr, ca., 1914, quando Bohr sucedeu Charles Galton Darwin como o Schuster Reader em Física Matemática em Manchester. Crédito: AIP Emilio Segre Visual Archives, Margrethe Bohr Collection.contra este pano de fundo distraído, Rutherford e seu mordomo de laboratório, William Kay, começaram em 1917 a explorar a passagem de partículas α através de hidrogênio, nitrogênio e outros gases. Quando a Grande Guerra terminou, Ernest Marsden ajudou brevemente com as tediosas observações de cintilação que forneciam pistas sobre a natureza do núcleo. Rutherford reported the tentative results of these extensive experiments in 1919., Rutherford colocou uma fonte de rádio C (bismuto-214) em um recipiente de latão selável, montado de modo que a posição da fonte poderia ser alterada e de modo que diferentes gases poderiam ser introduzidos ou um vácuo produzido, conforme desejado. As partículas α atravessaram o interior do recipiente e passaram por uma fenda, coberta por uma placa de prata ou outro material, e atingiram uma tela de sulfeto de zinco, onde uma cintilação foi observada em uma sala escura. Quando o gás hidrogênio foi introduzido no recipiente e foi tomado o cuidado de absorver as partículas α antes que elas atingissem a tela, cintilações ainda eram observadas., Rutherford postulou que como as partículas α atravessavam o gás hidrogênio, elas ocasionalmente colidiam com núcleos de hidrogênio. Como Rutherford escreveu, isso produziu “átomos de hidrogênio rápidos” que foram projetados principalmente para a frente na direção do movimento original das partículas α.Rutherford teve várias questões sutis em mente durante estes experimentos, principalmente relacionadas com a natureza do núcleo., Ele pediu ao seu colega de Darwin para analisar estas colisões com base em uma simples teoria ” de colisões elásticas entre o ponto núcleos repelida de acordo com uma lei do quadrado inverso, as partículas α carregando uma carga de 2 vezes a de um elétron (e de sinal oposto) e os núcleos de hidrogénio de 1 vezes. Darwin descobriu que todas as partículas α se aproximando dentro de 2.4×10-13 cm produziriam um átomo de hidrogênio rápido.”Esta teoria simples, no entanto, previu muito menos átomos de hidrogênio acelerados do que foram observados nos experimentos.,
Niels Bohr trabalhou pela primeira vez com Rutherford em Manchester em 1912. Esta foto mostra os jovens Niels e Margrethe Bohr, ca., 1914, quando Bohr sucedeu Charles Galton Darwin como o Schuster Reader em Física Matemática em Manchester. Crédito: AIP Emilio Segre Visual Archives, Margrethe Bohr Collection.contra este pano de fundo distraído, Rutherford e seu mordomo de laboratório, William Kay, começaram em 1917 a explorar a passagem de partículas α através de hidrogênio, nitrogênio e outros gases. Quando a Grande Guerra terminou, Ernest Marsden ajudou brevemente com as tediosas observações de cintilação que forneciam pistas sobre a natureza do núcleo. Rutherford reported the tentative results of these extensive experiments in 1919., Rutherford colocou uma fonte de rádio C (bismuto-214) em um recipiente de latão selável, montado de modo que a posição da fonte poderia ser alterada e de modo que diferentes gases poderiam ser introduzidos ou um vácuo produzido, conforme desejado. As partículas α atravessaram o interior do recipiente e passaram por uma fenda, coberta por uma placa de prata ou outro material, e atingiram uma tela de sulfeto de zinco, onde uma cintilação foi observada em uma sala escura. Quando o gás hidrogênio foi introduzido no recipiente e foi tomado o cuidado de absorver as partículas α antes que elas atingissem a tela, cintilações ainda eram observadas., Rutherford postulou que como as partículas α atravessavam o gás hidrogênio, elas ocasionalmente colidiam com núcleos de hidrogênio. Como Rutherford escreveu, isso produziu “átomos de hidrogênio rápidos” que foram projetados principalmente para a frente na direção do movimento original das partículas α.Rutherford teve várias questões sutis em mente durante estes experimentos, principalmente relacionadas com a natureza do núcleo., Ele pediu ao seu colega de Darwin para analisar estas colisões com base em uma simples teoria ” de colisões elásticas entre o ponto núcleos repelida de acordo com uma lei do quadrado inverso, as partículas α carregando uma carga de 2 vezes a de um elétron (e de sinal oposto) e os núcleos de hidrogénio de 1 vezes. Darwin descobriu que todas as partículas α se aproximando dentro de 2.4×10-13 cm produziriam um átomo de hidrogênio rápido.”Esta teoria simples, no entanto, previu muito menos átomos de hidrogênio acelerados do que foram observados nos experimentos.,
Rutherford rejeitou explicações desta variância com base em diferentes taxas sobre as partículas ou outras leis que não as leis do quadrado inverso. Em vez disso, ele concluiu que para distâncias na ordem do diâmetro do elétron, ‘a estrutura do núcleo de hélio não pode mais ser considerada como um ponto…’. He posited that the helium nucleus (α particle) has a complex structure of four hydrogen nuclei plus two negatively charged electrons. (Diríamos que é composto por dois protões., Rutherford concluiu que a deformação de núcleos complexos durante colisões era uma explicação mais provável, a variação das forças entre os núcleos variava de forma complexa em uma aproximação próxima.tendo em conta as intensas forças colocadas em jogo em tais colisões, não seria surpreendente se o núcleo de hélio se rompesse. Nenhuma evidência de tal desintegração foi observada, indicando que o núcleo de hélio deve ser uma estrutura muito estável.,
devemos lembrar que Rutherford não pôde observar diretamente a estrutura do núcleo, então suas conclusões foram hesitantes. No entanto, ele estava considerando abertamente as possibilidades de um núcleo complexo, capaz de deformação e até de possível desintegração. Estes pensamentos moldaram este período intenso de pesquisas experimentais.