Um ácido-base (proton transfer) reação
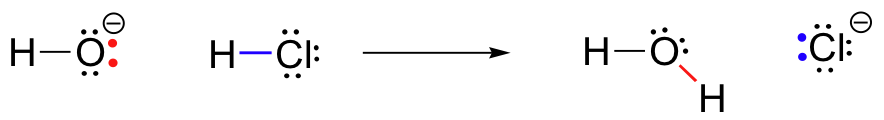
Para o nosso primeiro exemplo de reatividade química, vamos olhar para uma simples reação que ocorre entre o hidróxido de iões e ácido clorídrico:
HCl+OH^- \Rightarrow H_20+Cl^-
Este é um ácido-base de reação: um próton é transferido de HCl, ácido, a base de hidróxido de base. O produto é água (o ácido conjugado de hidróxido) e ião cloreto (a base conjugada de HCl)., Sem dúvida que já viu esta reacção antes em Química Geral. Apesar de sua simplicidade (e apesar do fato de que os reagentes e produtos são inorgânicos, ao invés de incluir orgânica), esta reação permite-nos considerar, pela primeira vez, muitas das ideias fundamentais da química orgânica que iremos explorar em vários contextos ao longo deste texto.
Key to understanding just about any reaction mechanism is the concept of electron density, and how it is connected to the electron movement (bond-breaking and bond-forming) that occurs in a reaction., O íon hidróxido – especificamente, o átomo de oxigênio eletronegativo no íon hidróxido – tem alta densidade de elétrons devido à carga negativa e a polaridade da ligação hidrogênio-oxigênio. O oxigénio hidróxido é rico em electrões.

o átomo de hidrogénio em HCl, por outro lado, tem baixa densidade de electrões: é pobre em electrões. Como você pode esperar, algo que é rico em elétrons é atraído por algo que é pobre em elétrons., À medida que o hidróxido e o HCl se aproximam um do outro, um par solitário de elétrons no oxigênio do hidróxido rico em elétrons é atraído pelo próton pobre em elétrons do HCl, e o movimento dos elétrons ocorre em direção ao próton. Os dois elétrons na ligação hidrogênio-cloro sigma são repelidos por esta aproximação da densidade de elétrons de hidróxido, e, portanto, se movem ainda mais longe do próton e em direção ao núcleo de cloro., A consequência de todo este movimento de elétrons é que a ligação hidrogênio-cloro é quebrada, uma vez que os dois elétrons dessa ligação se libertam completamente do orbital 1s do hidrogênio e se tornam um par solitário no orbital 3p de um anião cloreto.
Ao mesmo tempo que o hidrogênio, cloro, bond é quebrar, um novo sigma vínculo se forma entre o hidrogênio e o oxigênio, que contém dois elétrons que anteriormente eram um par solitário em hidróxido. O resultado desta formação de ligação é, naturalmente, uma molécula de água.anteriormente (Secção 6. 1.,), vimos como as setas curvas foram usadas para descrever o Movimento Eletrônico que ocorre em reações químicas, onde as ligações são quebradas e novas ligações são formadas. A reação HCl + OH, por exemplo, é representada desenhando duas setas curvas.
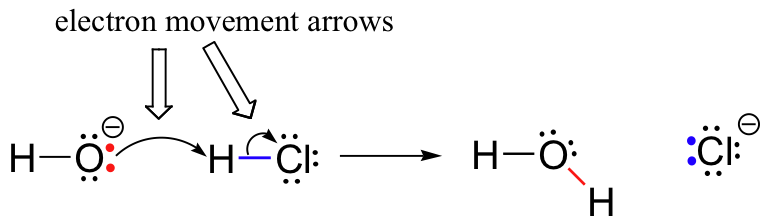
a primeira seta origina-se num dos pares solitários do oxigénio hidróxido e aponta para o símbolo ” H “na molécula de brometo de hidrogénio, ilustrando o “ataque” do Par solitário de oxigénio e a formação subsequente da nova ligação hidrogénio-oxigénio., A segunda seta curva origina-se na ligação hidrogênio – bromo e aponta para o símbolo “Br”, indicando que esta ligação está quebrando-os dois elétrons estão “deixando” e se tornando um par solitário em íon brometo.
é muito importante enfatizar neste ponto que estas setas curvas de duas barbas sempre representam o movimento de dois elétrons. A maior parte deste livro será dedicada à descrição dos mecanismos de reação envolvendo movimento de dois elétrons, de modo que estas flechas de cabeça cheia se tornarão muito familiares.,

no segundo semestre, no entanto, vamos olhar para mecanismos de reação radical, onde o movimento de um único elétron ocorre. Para estes processos, será utilizada uma seta curva, de um só baralho (“anzol de peixe”).
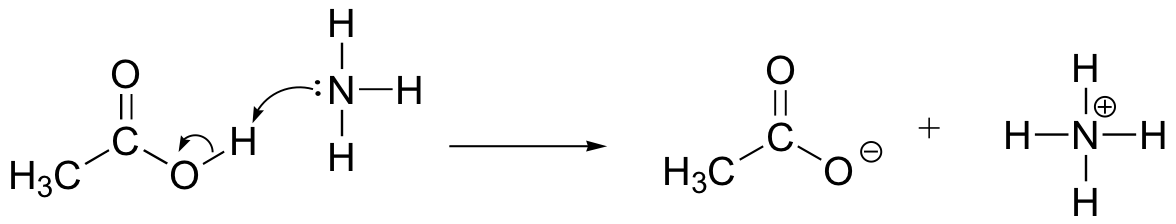
exercício
Draw electron movement arrows to illustrate the acid-base reaction between acético acid, CH3COOH, and ammonia, NH3. Desenha todas as estruturas de Lewis de reagentes e produtos.