óxido Férrico, também chamado pelo seu nome IUPAC ferro tri-hidrato ou de ferro(III) óxido, é uma inorgânico composto representado pela fórmula química Fe2O3 ou Fe2H6O3 . É um dos mais importantes óxidos de ferro, sendo os outros dois o óxido ferrosoferrico (Fe3O4) e o óxido ferroso (FeO), respectivamente . Ocorre naturalmente como a hematita mineral .,
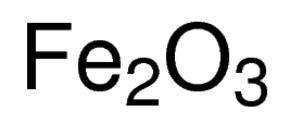
Óxido Férrico Fórmula
Óxido Férrico Hidratado
trata-se de um marrom-avermelhado gelatinosa do composto produzido na adição de álcali para soluções contendo Fe(III) de sais. É também chamado óxido férrico hidro e pode ser representado quimicamente como Fe2O3.H2O ou Fe (O)OH . Algumas formas comuns de óxido férrico hidratado incluem lepidocrocite vermelha que ocorre externamente em rusticles e goetite laranja que ocorre no interior dos rustículos.,o óxido férrico é sintetizado em laboratório através da electrólise de uma solução de bicarbonato de sódio, que actua como um electrólito inerte e um ânodo de ferro. O eletrolítico de conversão de ferro em hidratados de ferro (III) óxido é representado como:
4Fe + 3O2 + 2H2O → 4 FeO(OH)
O hidratado de ferro (III) óxido, assim produzido, sofre desidratação em torno de 200 °C para formar óxido férrico ., para o sulfato ferroso (FeSO4), que é oxidado a sulfato férrico :
- FeS2 + 7O+ H2O → FeSO4 + H2SO4
- 2FeSO4 + H2SO4 + O → Fe2(SO4)3 + H2O
de Alumínio substitui o Ferro de Óxido Férrico
de Alumínio e óxido férrico sofrer uma reacção redox pelo qual o metal substitui o ferro para formar óxido de alumínio:
Fe2O3 + 2al reservas → Al2O3 + 2Fe
Propriedades e Características de Óxido Férrico
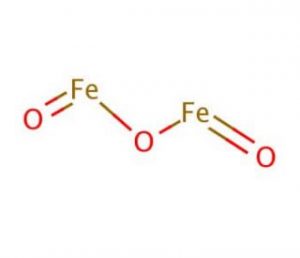
Estrutura de Óxido Férrico
Usa
- Em indústrias de ferro para a produção de aço e ligas .,pó de óxido férrico, também chamado de rouge do joalheiro, é usado para polir Lentes e jóias metálicas .a sua forma granular é utilizada como meio de filtração para extrair fosfatos em aquários de água salgada .
- Como pigmento Castanho 6 aprovado pela FDA e pigmento vermelho 101, para utilização em cosméticos .em aplicações biomédicas, porque as suas nanopartículas não são tóxicas e biocompatíveis .a exposição prolongada à sua fumaça ou poeira pode resultar em pneumoconiose com febre, arrepios, dores, falta de ar e tosse ., O contacto repetido com os olhos pode descolori-lo e causar manchas permanentes de ferro .
- de Ferro(III) óxido de Chemspider.com
- Óxido Férrico Vermelho – Pubchem.ncbi.nlm.hih.gov
- Magnetita (Fe3O4) – Pubchem.ncbi.nlm.nih.gov
- óxido Ferroso – Pubchem.ncbi.nlm.nih.gov
- CHEBI:50819 – óxido férrico – Ebi.ac.reino unido
- Óxido de Ferro, Poeira e Fumos (como Fe) – Cdc.gov
- a Cinética e o mecanismo de desidratação de γ-FeOOH – Researchgate.net
- de Ferro(III) Partículas de Óxido – Americanelements.com
- Óxido Férrico – Chemicalbook.,com
- Propriedades Magnéticas dos Materiais – Sigmaaldrich.com
- de Ferro(III) Óxido de Chem.libretexts.org
- Óxido de Ferro (Fe2O3), Alimentar (Composto) – Pubchem.ncbi.nlm.nih.gov
- A oxidação de sulfato ferroso para férrico sulfato por meio de ar – Archive.org
- Usa de Óxido de Ferro – Zjunited.com
- Substância Perigosa Folha de Óxido de Ferro – Nj.gov