Un acid-bază (transfer de protoni) reacție
Pentru primul nostru exemplu de reactivitatea chimică, să ne uităm la un foarte simplu reacția care are loc între hidroxid de ion și acid clorhidric:
HCl+OH^- \Rightarrow H_20+Cl^-
Aceasta este o reacție acido-bazic: un proton este transferat de HCl, acid, să hidroxid de baza. Produsul este apa (acidul conjugat al hidroxidului) și ionul de clorură (baza conjugată a HCl)., Ați văzut, fără îndoială, această reacție înainte în chimia generală. În ciuda simplității sale (și în ciuda faptului că reactanții și produsele sunt mai degrabă anorganice decât organice), această reacție ne permite să luăm în considerare pentru prima dată multe dintre ideile fundamentale ale chimiei organice pe care le vom explora în diferite contexte în acest text.cheia înțelegerii oricărui mecanism de reacție este conceptul de densitate electronică și modul în care este conectat la mișcarea electronilor (ruperea legăturilor și formarea legăturilor) care are loc într-o reacție., Ionul de hidroxid – în mod specific, atomul de oxigen electronegativ din ionul de hidroxid-are o densitate electronică ridicată datorită încărcării negative și polarității legăturii hidrogen-oxigen. Hidroxidul de oxigen este bogat în electroni.

atomul de hidrogen din HCl, pe de altă parte, are o densitate electronică scăzută: este slab de electroni. Așa cum v-ați putea aștepta, ceva care este bogat în electroni este atras de ceva care este sărac în electroni., Pe măsură ce hidroxidul și HCl se apropie unul de celălalt, o pereche singură de electroni pe oxigenul hidroxid bogat în electroni este atrasă de protonul slab de electroni al HCl, iar mișcarea electronilor are loc spre proton. Cei doi electroni din legătura Sigma hidrogen-clor sunt respinși de această densitate de electroni de hidroxid care se apropie și, prin urmare, se deplasează și mai departe de proton și spre nucleul de clor., Consecința toate acestea electron mișcarea este că hidrogen-clor bond este rupt, ca doi electroni de legătură rupe complet gratuit de la orbital 1s al hidrogenului și a devenit un singuratic pereche 3p orbital de clorură de anioni.în același timp în care legătura hidrogen-clor se rupe, se formează o nouă legătură sigma între hidrogen și oxigen, conținând cei doi electroni care anterior erau o pereche singură pe hidroxid. Rezultatul acestei formări de legături este, desigur, o moleculă de apă.anterior (secțiunea 6.1.,), am văzut cum săgețile curbate au fost folosite pentru a descrie mișcarea electronilor care apare în reacțiile chimice, unde legăturile sunt rupte și se formează noi legături. Reacția HCl + OH, de exemplu, este descrisă prin desenarea a două săgeți curbate.
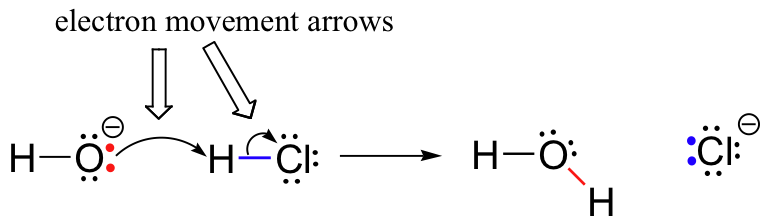
prima săgeată provine de la unul dintre singuratic perechi pe hidroxid de oxigen și indică simbolul ” H „în bromură de hidrogen a moleculei, care ilustrează „atac” de oxigen singuratic pereche și formarea ulterioară de noi hidrogen-oxigen bond., A doua săgeată curbată provine de la legătura hidrogen-brom și indică simbolul „Br”, indicând faptul că această legătură se rupe – cei doi electroni „părăsesc” și devin o pereche singură pe ionul de bromură.este foarte important să subliniem în acest moment că aceste săgeți curbate, cu două ghimpe reprezintă întotdeauna mișcarea a doi electroni. Cea mai mare parte a acestei cărți va fi dedicată descrierii mecanismelor de reacție care implică mișcarea cu doi electroni, astfel încât aceste săgeți cu cap complet vor deveni foarte familiare.,

În al doilea semestru, cu toate acestea, vom analiza mecanismele de reacție radicală, unde are loc mișcarea cu un singur electron. Pentru aceste procese, se va folosi o săgeată curbată, cu o singură ghimpată („cârlig de pește”).
exercițiu
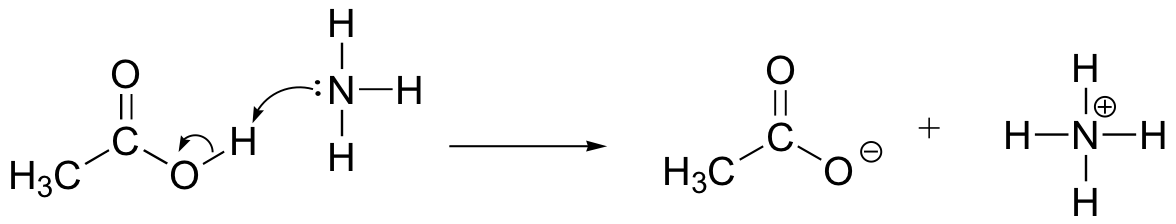
desenați săgețile de mișcare a electronilor pentru a ilustra reacția acido-bazică dintre acidul acetic, CH3COOH și amoniacul, NH3. Desenați structurile complete Lewis ale reactanților și produselor.