Introducere
Adipos derivate din celulele stromale (ASCs) sunt multipotente și immunoprivileged, ceea ce le face ideale candidați pentru scopuri terapeutice (Bourin et al., 2013; Ma și colab., 2014; Kallmeyer și Pepper, 2015). ASCs pot fi izolate folosind tehnici minim invazive din diferite depozite de țesut adipos din organism (Zuk et al., 2001)., Acestea se caracterizează prin capacitatea lor de a adera la plastic, un profil unic de marker de suprafață și capacitatea de a se diferenția în os, grăsime și cartilaj (Dominici et al., 2006; Bourin și colab., 2013). ASCs cuprind ~15-30% din fracția vasculară stromală (SVF) a țesutului adipos (Bourin și colab., 2013; Zuk, 2013) și trebuie extins ex vivo pentru a obține un număr suficient de celule în scopuri terapeutice.,furnizarea de produse de terapie celulară sigure și reglementate pacienților necesită respectarea bunelor practici de fabricație (GMP), iar ghidurile GMP trebuie respectate pe tot parcursul procesului de izolare, extindere și diferențiere a ASCs (Giancola et al., 2012). Numeroase reactivi utilizate pentru a izola și de a extinde ASCs pentru scopuri de cercetare sunt de origine animală sau nu sunt clinic de calitate; prin urmare, acestea trebuie să fie înlocuite cu alternative mai adecvate în conformitate cu standardele GMP (Halme și Kessler, 2006; Riis et al., 2015)., Analizăm alegerea suplimentării serice care poate fi utilizată pentru extinderea ASC în locul serului fetal bovin (FBS) și descriem efectele lor in vitro și in vivo, așa cum sunt raportate în literatura de specialitate.,
Societatea Internațională de Terapie Celulară (ISCT) și Internaționale Grăsime Tehnologia Aplicată Societății (IFATS) Orientări și Tehnici Utilizate pentru a Evalua Adipos Derivate din Celule Stromale Caracteristici
Un set minim de criterii și linii directoare au fost recomandate de Societatea Internațională de Terapie Celulară (ISCT) și Internaționale Grăsime Tehnologia Aplicată Societății (IFATS) pentru caracterizarea ASCs (Dominici et al., 2006; Bourin și colab., 2013)., Aceste criterii includ capacitatea ASCs de a adera la plastic, profilul marker de suprafață și potențialul lor de diferențiere trilineage. Ultimul document de poziție descrie viabilitatea și proliferarea ca măsurători suplimentare față de criteriile de caracterizare inițiale. Mai mult, au fost definite metode experimentale și teste pentru a măsura criteriile de caracterizare (Bourin et al., 2013)., Aceste criterii au fost dovedit a fi afectată de numeroși factori, cum ar fi liposuctia tehnica, SVF izolare tehnica și mass-media și suplimentarea utilizate în timpul procesului de expansiune (Koellensperger et al., 2014; Bajek și colab., 2015; Busser și colab., 2015). Potrivit ISCT și IFATS orientări, este recomandat și acceptate în practica de cercetare pentru a confirma aderarea la liniile directoare de mai sus pentru fiecare izolarea și starea culturii în scopul de a clasifica rezultat populație de celule ca ASCs.,
Tehnici și Metode Utilizate pentru a Caracteriza ASCs
Morfologia și Respectarea
Odată însămânțat, aderent ASCs afișa un morfologia distinctă, care poate fi descris la fel de subtire, alungit și în formă de fus. Morfologice evaluare a ASCs este, de obicei, efectuate folosind microscopie optică (Trojahn Kølle et al., 2013).
Proliferarea
ISCT și IFATS orientări au recomandat că proliferarea și frecvența precursoare ACSs sunt măsurate de o fibroblastoid unitate formatoare de test (Bourin et al., 2013)., Alte tehnici utilizate în studiile citate în această revizuire utilizează numărarea celulelor viabile sau măsurarea capacității proliferative a ASCs utilizând imunohistochimia. Metode de numărare includ (1) numărarea celulelor folosind un viabilitatea colorant și un hemocytometer, (2) numărarea celulelor folosind fie de numărare margele sau colorare și tehnici de citometrie în flux de analiză, și (3), folosind teste colorimetrice că măsura celule viabile într-un spectrofotometru (Gharibi și Hughes, 2012; Trojahn Kølle et al., 2013; Bogdanova și colab., 2014; Atashi și colab., 2015; Johal și colab., 2015; Oikonomopoulos și colab., 2015).,
Imunofenotipul
ISCT și IFATS orientări enumerate expresia mai multor markeri de suprafață și de așteptat procente ca o cerință fermă în poziția lor declarație. Ei au recomandat, de asemenea, ca expresia markerului de suprafață să fie măsurată prin colorarea anticorpilor multicolori (Bourin et al., 2013). Studiile din această revizuire au utilizat analiza citometrică a fluxului pentru a măsura expresia markerului de suprafață (Müller et al., 2006; Lindroos și colab., 2009; Chieregato și colab., 2011; Josh și colab., 2012; Trojahn Kølle și colab., 2013; Bogdanova și colab., 2014; Patrikoski și colab., 2014).,
Trilineage Diferențiere
Diferențiere în adipos, oaselor, cartilajelor și a fost în mod tradițional măsurată cu ajutorul histochimice tehnici de colorare vizualizate sub microscopie; cu toate acestea, ISCT și IFATS orientări au recomandat evaluări calitative ar trebui să fie înlocuite sau completate cu abordări cantitative, cum ar fi de măsurare lineage specifice de exprimare a arnm cu ajutorul revers transcriere cantitative polymerase chain reaction (RT-pcr), tehnici (Bourin et al., 2013)., Tehnicile care au fost utilizate pentru a măsura capacitatea de diferențiere, descrise în studiile citate în această revizuire, au variat de la colorarea histochimică, la PCR convențional și RT-qPCR. Histochimic colorare tehnici includ colorarea celulelor cu fie (1) oil red O și nil roșu pentru adipogenesis; (2) roșu de Alizarină S, fosfatazei alcaline și von Kossa pentru osteogeneză; sau (3) albastru Alcian și safranin pentru condrogenezei (Müller et al., 2006; Kocaoemer și colab., 2007; Hebert și colab., 2010; Rajala și colab., 2010; Koellensperger și colab., 2014; Oikonomopoulos și colab., 2015; Riis și colab., 2016).,
suplimentarea serului
ser fetal bovin
FBS este suplimentul seric tradițional utilizat pentru cultura celulară. FBS conține factori de creștere (GFs) și alte elemente esențiale pentru atașarea, extinderea, Întreținerea și proliferarea ASC in vitro (Lennon et al., 1995, 1996; Zuk și colab., 2001; van der Valk și colab., 2010). FBS este predispus la variații lot-la-lot, xenoimunizare și posibila contaminare cu micoplasme, viruși, endotoxine și prioni (van der Valk și colab., 2004, 2010; Chieregato și colab., 2011; Kyllonen și colab., 2013; Jin și colab., 2015)., Sursa și calitatea FBS poate afecta proliferare și diferențiere a ASCs, și screening-ul de rutină pentru mycoplasma, endotoxine și viruși a devenit important (Naaijkens et al., 2012). Acești factori pot afecta rezultatele experimentale și pot face ca produsul celular să fie nesigur pentru uz clinic (Zuk et al., 2001; van der Valk și colab., 2004; Witzeneder și colab., 2013).
ASCs sunt immunoprivileged, lipsit de expresie a complexului major de histocompatibilitate clasa a II-a precum și a celulelor T și B, de costimulare molecule (CD80, CD86, și CD40)., In vitro imunogenitate și proprietăți imunosupresoare de ASCs sunt de obicei măsurate prin co-cultivarea ASCs cu celulele mononucleare din sângele periferic în amestec de limfocite reacții de măsurare și T-celule proliferative răspuns (McIntosh et al., 2006; Patrikoski și colab., 2014). ASCs demonstrează proprietăți imunomodulatoare și imunosupresoare, demonstrate prin capacitatea lor de a regla funcția celulelor T și de a modula secreția de citokine in vitro și in vivo (Leto Barone et al., 2013; Roemeling-van Rhijn și colab., 2013; Patrikoski și colab., 2014)., Aceste proprietăți apar din cauza imunogenității scăzute a ASCs. Majoritatea ASC și a altor studii clinice cu celule stem mezenchimale (MSC) (Faza I, II și III) utilizează medii suplimentate cu FBS și sa raportat că efectele imunogene sunt provocate de componentele FBS la subiecții umani (Sundin et al., 2007; Riis și colab., 2015). De exemplu, un studiu clinic care utilizează MSCs derivate din măduva osoasă (BM-MSCs) extins în FBS a găsit anticorpi împotriva componentelor FBS (Horwitz et al., 2002)., Răspunsurile imune la FBS, cum ar fi Arthus și reacțiile anafilactice, au fost raportate în studiile clinice, în care pacienții au fost tratați cu celule dendritice și limfocite expuse la FBS (Selvaggi et al., 1997; Mackensen și colab., 2000). În schimb, o meta-analiză a studiilor clinice MSC a constatat că peste 75% din experimente au folosit FBS în protocoalele lor de expansiune celulară și un singur studiu a monitorizat și a demonstrat reacții adverse la FBS (Lalu et al., 2012)., Studiile in vivo care examinează răspunsul imun al șoarecilor la ASCs au arătat imunosupresie și imunomodulare conservate, imunogenitate scăzută și nici o reacție la FBS (Cho et al ., 2009; González și colab., 2009). Deși ASCs sunt testate extensiv în studiile clinice, utilizarea lor definitivă ca agent terapeutic rămâne de stabilit. Acest lucru este agravat și de utilizarea modelelor preclinice care pot să nu fie relevante din punct de vedere biologic (Monsarrat et al., 2016). Mai mult, FBS poate fi mai puțin imunogen la șoareci și alte modele animale decât la om., În cele din urmă, răspunsul imun provocat de FBS (Selvaggi et al., 1997; Mackensen și colab., 2000; Horwitz și colab., 2002) ar putea influența teoretic respingerea celulelor transplantate în terapia pe bază de celule.
alternative fără ser
compoziția necunoscută și nedefinită a FBS este un dezavantaj major. O alternativă preferabilă ar fi un mediu definit chimic cu o compoziție cunoscută, cum ar fi mediile fără ser (SF) sau XF disponibile în comerț (Usta et Al., 2014)., Aceste medii fără ser se presupune în mod eronat că sunt lipsite de produse de origine animală, deoarece termenii SF și XF sunt adesea folosiți în mod interschimbabil. Cu toate acestea, mediile SF sunt de obicei completate cu albumină serică animală sau umană și GFs în cantități nedefinite (Patrikoski et al., 2013). Mediile fără xenon, pe de altă parte, sunt medii definite chimic care conțin componente bine definite la concentrații specifice (Usta et Al., 2014).o altă alternativă la SER este adăugarea GFs la mediul de cultură, fie izolat, fie ca un cocktail., Aceste GFs pot fi sintetice, derivate de la animale sau derivate de la om. Înlocuirea cu GFs sintetice este preferabilă datorită calității lor superioare și ca urmare a standardizării între loturi, ceea ce poate să nu fie posibil pentru GFs de origine animală sau umană. GFs utilizate frecvent sunt factorul de creștere a fibroblastelor, factorul de creștere epidermal și factorul de creștere derivat din trombocite (PDGF; Baer și Geiger, 2012; Ahearne și colab., 2014). Adăugarea GFs a fost legată de o creștere a proliferării (Hebert et al., 2010; Gharibi și Hughes, 2012)., Un potențial îmbunătățit de diferențiere adipogenică a fost raportat anterior în ASCs extins în mediul suplimentat GF (Hebert et al., 2010). Cu toate acestea, un alt studiu a observat un efect negativ asupra adipogenic și diferențierii osteogenice în pe termen lung de cultură ASCs (Gharibi și Hughes, 2012).albumina serică este o proteină plasmatică abundentă și poate fi izolată de oameni și animale. Adesea mediile SF sunt completate cu albumină serică., Studiile care au comparat albumină serică umană pentru ASC media suplimentarea au găsit îmbunătățit proliferarea, un mic ax-ca morfologie și conservate diferențiere în adipos, oase și cartilaje (Rajala et al., 2010; Johal și colab., 2015).mediul XF definit chimic a fost recomandat ca înlocuitor pentru FBS și ser, deoarece conține componentele necesare pentru extinderea ASC, nu implică variații de la donator sau lot la lot, este conform GMP și are imunogenitate minimă și imunosupresie favorabilă (van der Valk et al., 2004, 2010; Usta și colab.,, 2014). În comparație cu FBS, utilizarea XF mediu pentru extinderea ASCs a condus la o mai bună calitatea morfologică, a crescut de proliferare, un comparabile imunofenotipul și diferențierea într-adipos, oase și cartilaje (Lindroos et al., 2009; Patrikoski și colab., 2013; Oikonomopoulos și colab., 2015). Utilizarea mediilor XF în expansiunea ASC duce la pierderea capacității ASCs de a adera la plastic (Kyllonen et al., 2013; Patrikoski și colab., 2013; Oikonomopoulos și colab., 2015). Sunt necesari agenți de acoperire suplimentari pentru a menține caracteristica inerentă a aderenței plastice asociate cu ASCs., Mediul XF Disponibil în comerț este scump, iar pregătirea mediului XF intern poate dura mult timp și poate crește riscul de variație a lotului la lot (Lund et al., 2009; Baer și colab., 2010; Rajala și colab., 2010; Yang și colab., 2012; Kyllonen și colab., 2013; Patrikoski și colab., 2013; Oikonomopoulos și colab., 2015).alternativele umane pot înlocui mediile completate de FBS și SF / XF și pot crea un mediu de cultură care seamănă mai exact cu mediul uman (Azouna et al., 2012; Koellensperger și colab., 2014)., În plus, utilizarea produselor autologe (derivate de la aceeași persoană) elimină necesitatea testării agenților infecțioși și a altor agenți cauzatori de boli.după ce sângele integral a fost lăsat să se coaguleze în absența unui anticoagulant și a fost centrifugat, serul este porțiunea lichidă rezultată care nu conține trombocite, globule albe sau globule roșii (Figura 1; Stedman, 2006). Serul uman (HS) poate fi autolog (donatorul și destinatarul sunt același individ) sau alogen (derivat de la persoane care sunt diferite de destinatar)., Atât autolog și HS alogen sunt superioare FBS (Stute et al., 2004; Bieback și colab., 2009, 2012; Bernardo și colab., 2011; Kyllonen și colab., 2013; Patrikoski și colab., 2013). ASCs extins în HS au o mai mare transcriptomului stabilitate decât cele extins în FBS, întrucât genele responsabile pentru prelungirea ciclului celular, diferențiere și matrice extracelulară și sinteza de prostaglandine sunt supraexprimate și supraexprimate în FBS în comparație cu HS folosind analiza microarray (Shahdadfar et al., 2005)., ASCs extins în FBS ajuns la senescență mai devreme și afișate scurtare a telomerilor, comparativ cu ASCs extins în HS (Shahdadfar et al., 2005). Alegerea HS pare să aibă un efect redus asupra proprietăților imunomodulatoare ale ASCs. ASCs extins în orice alogen HS sau FBS conțin mass-media au scăzut imunogenitate și au dus la imunosupresie (Patrikoski et al., 2014). ASCs extins în fie autolog sau alogen HS display mai mare proliferare și o imposibil de distins imunofenotipul comparativ cu ASCs extins în FBS (Josh et al., 2012; Bogdanova și colab., 2014)., ASCs extins în HS alogen au fost diferențiate în adipos, OS și cartilaj, deși upregulation genelor condrogenice și osteogenice a fost favorizat în comparație cu FBS (Josh et al., 2012). ASCs extins în HS autolog au fost diferențiate în adipos și cartilaj; cu toate acestea, capacitatea de a se diferenția în os a fost mai puțin favorizată (Bogdanova et al., 2014). HS autologă poate oferi ASCs o proliferare mai bună și o stabilitate genomică determinată prin analiza microarray în comparație cu HS alogen (Shahdadfar et al., 2005; Bieback și colab., 2009; Bernardo și colab., 2011)., ASCs sa extins în HS alogen a intrat în stoparea creșterii și a suferit moartea celulelor (Shahdadfar et al., 2005; Lindroos și colab., 2009), care limitează avantajele potențiale ale HS alogen. Deși HS autolog poate fi ideal, disponibilitatea sa este limitată și pot exista variații semnificative între pacienți în ceea ce privește capacitatea propriului ser de a susține creșterea propriilor celule (Lange et al., 2007). Alternativ, HS alogen poate fi comasat, obținându-se cantități mai mari pentru experimente de laborator și poate fi supus unor teste riguroase de calitate de către o bancă de sânge (de exemplu,,, testarea absenței agenților infecțioși și contaminarea cu alte celule sanguine) înainte de utilizare la om (Bieback et al., 2009).
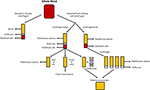
Figura 1. Producerea diferitelor alternative umane. Serul este produs atunci când sângele integral este lăsat să se coaguleze și centrifugat pentru a peleta celulele roșii și albe din sânge și trombocitele. Plasma este produsă prin prevenirea coagulării urmată de centrifugare., În funcție de viteza de centrifugare, se produce fie plasmă săracă în trombocite (PPP; centrifugare rapidă), fie plasmă bogată în trombocite (PRP; centrifugare mai lentă). Dacă PPP este păstrat la -18°C, este cunoscut sub numele de plasmă proaspătă congelată. Concentratele plachetare pot fi produse fie prin prelevarea plasmei plachetare sărace și a 4 straturi buffy și punerea în comun a acestora, fie prin centrifugarea mai multor PRP-uri și prin gruparea peletelor plachetare (suspendate într-o cantitate mică de plasmă) împreună.,Plasma este porțiunea lichidă necelulară a sângelui care conține apă, electroliți și proteine (factori de coagulare, fibrinogen și anticoagulante). Plasma săracă în trombocite (PPP), plasma proaspătă congelată (FFP) și plasma bogată în trombocite (PRP; Figura 1) pot fi obținute din sânge integral prin centrifugare la viteze diferite și depozitare ulterioară la temperaturi diferite. Secreția GF poate fi îmbunătățită prin activarea trombocitelor din sângele integral cu trombină înainte de centrifugare (Doucet et al., 2005; Kocaoemer și colab.,, 2007), sporind astfel activitatea produselor plasmatice.PPP este aproape lipsit de trombocite și este produs din sânge integral prin adăugarea unui anticoagulant în timpul procesului de colectare, după care plasma este separată folosind centrifugare rapidă (Figura 1; Koellensperger et al., 2006). Acest lucru permite ca trombocitele și globulele roșii să fie granulate. PPP-ul rezultat este păstrat la 4°C și este denumit plasmă proaspătă., PDGF este secretat de trombocitele agregatoare; cu toate acestea, PDGF neglijabil este eliberat în PPP ca urmare a numărului mic de trombocite reziduale. Prin urmare, GFs poate fi necesar să fie adăugat la PPP atunci când este utilizat în media, cum este cazul când se utilizează mediul SF (Müller et al., 2006; Gottipamula și colab., 2013). Utilizarea PPP fără adăugarea GFs a dus la rate de proliferare mai mici și la o creștere mai mică a sintezei ADN, măsurată prin încorporarea timidinei, în comparație cu HS și FBS (Vogel et al., 1980; Koellensperger și colab., 2006)., PPP cu GFs adăugat a dus la creșterea ratelor de proliferare în comparație cu HS (Koellensperger et al., 2006); cu toate acestea, aceste diferențe ar fi putut apărea din protocoalele de producție diferite ale PPP și din adăugarea unor niveluri diferite de GFs la fiecare dintre preparatele PPP din acest studiu. Extinderea ASCs în PPP rezultate în îmbunătățirea proliferarea comparativ cu FBS, și a diferențierii osteogenice care este comparabil cu cel al ASCs extins în HS (Koellensperger et al., 2014)., Condrogenic diferențiere a scăzut în ASCs extins în PPP în comparație cu ASCs extins în PRP (Koellensperger et al., 2014).
plasmă proaspătă congelată
FFP este obținut în același mod ca PPP, dar este congelat direct după separare la -18°C (O ‘ Shaughnessy et al., 2004; Liumbruno și colab., 2009). FFP a fost utilizat în extinderea BM-MSCs cu rezultate pozitive., Aceste rezultate includ proliferarea mai bună, activitatea imunosupresoare și diferențierea în adipocite și osteocite; și un imunofenotip și o morfologie comparabilă cu celulele extinse în FBS (Müller et al., 2006; Mannello și Tonti, 2007). Cu toate acestea, utilizarea FFP ca înlocuitor de ser în expansiunea ASC necesită investigații suplimentare.
plasma bogată în trombocite
PRP este porțiunea de sânge care este îmbogățită în trombocite. PRP este produs prin separarea plasmei de globulele roșii la viteze mai mici de centrifugare, ceea ce împiedică granularea trombocitelor (Figura 1)., ASCs extins în PRP menține un clasic imunofenotipul și morfologia, și PRP crește proliferarea comparativ cu FBS (Kocaoemer et al., 2007; Chieregato și colab., 2011; Atashi și colab., 2015). ASCs extins în PRP-au îmbunătățit diferențiere eficiența spre adipogenic și osteogenice linii, având în același timp comparabile eficiența condrogenică diferențiere, comparativ cu ASCs extins în FBS (Kocaoemer et al., 2007; Chieregato și colab., 2011). În comparație, sa constatat că HS este puțin mai bun decât PRP în ceea ce privește diferențierea și proliferarea ASCs (Kocaoemer et al.,, 2007; Chieregato și colab., 2011). PRP este un supliment de mediu de cultură slab definit datorită variabilității sale biologice ridicate și procedurii complicate de extracție, în care purificarea supernatantului bogat în factori plachetari din membranele plasmatice poate fi dificilă. Utilizarea PRP este limitată de cantitățile mari de sânge integral necesare pentru a produce suficient PRP pentru experimentare (Chieregato et al., 2011).,lizatul plachetar uman (HPL) conține GFs plachetar care sunt obținute prin lizarea trombocitelor concentrate într-un volum mic de plasmă (concentrate plachetare; Figura 1) prin șoc termic. HPL conține o concentrație mai mare de SFG decât alți substituenți serici, inclusiv PRP uman și FBS (Doucet et al ., 2005; Bernardo și colab., 2006, 2011; Bieback și colab., 2009; Schallmoser și colab., 2010)., HPL pot fi obținute cu ușurință și produse din afereză produse și buffy haine, și pot fi reluate în orice PRP sau o soluție aditivă (Schallmoser și Ewen, 2013; Iudicone et al., 2014). HPL este produs prin înghețarea trombocitelor între -30 și -80°C timp de 24 de ore, urmată de o etapă de decongelare și centrifugare. Ciclurile repetate de înghețare, dezghețare și centrifugare permit eliberarea GFs și îndepărtarea corpurilor plachetare (Bernardo et al., 2006; Schallmoser și colab., 2007)., Un alt beneficiu al suplimentării cu HPL este că trombocitele pot fi utilizate după data de expirare a zilei 4-5 a sângelui bancar (Bieback et al., 2009). HPL este o alternativă mai bună decât autolog și alogen HS, ca ASCs extins în HPL-și mențină clasic imunofenotipul, diferențiere, clonogenic eficiență, celula de puritate, și viabilității celulare (Trojahn Kølle et al., 2013; Riis și colab., 2016). HPL sprijină, de asemenea, extinderea pe termen lung, fără a compromite proprietățile imunomodulatoare ale ASCs, măsurate prin analiza citometrică a fluxului (Bieback et al., 2009)., Expansiunea în HPL are ca rezultat un timp mai scurt de dublare a populației, reducând timpul necesar pentru expansiunea celulară și reducând amenințarea de senescență și transformare (Doucet et al., 2005; Shahdadfar și colab., 2005; Bernardo și colab., 2006, 2011; Azouna și colab., 2012). Bio-siguranța HPL a fost evaluată utilizând hibridizarea genomică comparativă array și cariotiparea spectrală de înaltă sensibilitate, unde s-a constatat că ASCs extins în HPL nu a avut aberații cromozomiale (Crespo-diaz et al., 2011; Trojahn Kølle și colab., 2013)., Clasic ASC morfologie (subțire, mici, alungite, și în formă de ax) este menținut în HS și HPL, întrucât ASCs extins în FBS sunt mai mari și mai puțin în formă de fus (Trojahn Kølle et al., 2013). Deși acest lucru poate indica faptul că atât HS, cât și HPL selectează pentru ASCs primitive/imature (Doucet et al., 2005; Bieback și colab., 2009), de asemenea, sugerează că celulele cultivate în FBS au redus proliferarea și progresul mai rapid spre senescență. HPL variază între indivizi (Bernardo et al., 2006; Crespo-diaz și colab., 2011), iar variația lot-la-lot este redusă atunci când HPL este pus în comun (Schallmoser et al.,, 2007; Trojahn Kølle și colab., 2013). Mai mult, prin punerea în comun a multor donatori, se poate obține o cantitate mare pentru suplimente, ceea ce face ca HPL să fie preferabil PRP (Kocaoemer et al., 2007; Bieback și colab., 2009; Chieregato și colab., 2011).
concluzie
conform lui Riis și colab. dintre toate studiile clinice înregistrate care utilizează ASCs extinse care și-au enumerat condițiile de expansiune, majoritatea utilizează FBS, trei studii utilizează HS autolog, un studiu utilizează PRP și un studiu utilizează HPL (Riis et al., 2015)., Aceste statistici sunt alarmante, deoarece FBS are potențialul de a transmite boli zoonotice în urma transplantului de celule și au fost raportate reacții imune împotriva componentelor FBS (Selvaggi et al., 1997; Mackensen și colab., 2000). FBS este un produs care nu respectă GMP, deoarece afectează siguranța și eficacitatea terapiei ASC și, prin urmare, trebuie înlocuit (van der Valk et al., 2004; Kyllonen și colab., 2013; Witzeneder și colab., 2013). Acest lucru a fost remediat prin înlocuirea FBS cu alternative derivate umane definite chimic., Schimbarea de la FBS omului alternative sau XF/SF mass-media în medicina regenerativă are marele avantaj că ASCs prolifera mult mai repede în cele din urmă, rezultând într-un număr mai mare de celule pentru transplant într-un timp mai scurt. Cu toate acestea, superioritatea relativă a diferitelor medii de cultură este încă dezbătută pe scară largă. Studiile care au comparat mai mult de un mediu de cultură au raportat rezultate diferite (Lange et al., 2007; Bernardo și colab., 2011; Koellensperger și colab., 2014; Riis și colab., 2016). Koellensperger și colab., comparat trilineage diferențiere a ASCs extins în FBS, PRP, PPP, și HS (Koellensperger et al., 2014). Rezultatele lor au arătat că fiecare mediu de cultură a permis diferențierea în una sau mai multe linii, dar niciodată în toate cele trei linii. Când au fost comparate mediile XF media, FBS și HPL, Riis și colab. s-a constatat că anumite subpopulații au exprimat markeri specifici de suprafață în funcție de mediul de cultură utilizat (Riis et al., 2016)., Studiile care au comparat imunofenotipul de ASCs extins în FBS și alte medii de cultură, a găsit puțin la nici o diferență în celula marker de suprafață exprimare, indiferent de markeri studiat (Tabelul 1). Densitatea de însămânțare, tensiunea oxigenului, confluența, disocierea și alegerea mediilor bazale pot influența, de asemenea, rezultatele experimentale (Sotiropoulou et al., 2006; Freshney, 2010; Bourin și colab., 2013; Inamdar și Inamdar, 2013; Feng și colab., 2014; Riis și colab., 2015)., Alegerea mediului de cultură depinde de aplicarea în aval a acestor celule (administrarea de ASCs diferențiate sau nediferențiate) și de afecțiunea tratată. În plus, imunogenitatea mediului de cultură utilizat pentru extinderea celulelor înainte de aplicarea clinică trebuie considerată ca un parametru care ar putea influența rezultatul clinic. Majoritatea studiilor care au comparat diferite medii de cultură au utilizat criteriile specificate de ISCT și IFATS pentru a valida utilizarea unei alternative la FBS., Cele mai multe dintre aceste studii examina ASC morfologie, proliferarea, imunofenotipul, și capacitatea acestor celule să se diferențieze de-a lungul osteogenic, condrogenic, și adipogenic linii în diferite medii de cultură. Câteva studii au explorat alte aspecte ale ASCs, cum ar fi îmbătrânirea, stabilitatea genetică, transcriptomului, proteome, imunogenitate, secreția de citokine, și ciclului celular (Shahdadfar et al., 2005; Bieback și colab., 2012). În timp ce criteriile ISCT și IFATS au fost o încercare de a unifica domeniul în ceea ce privește procedurile standard de operare (Dominici et al., 2006; Bourin și colab.,, 2013), nu există un consens în jurul căruia proprietățile ASCs sunt relevante pentru studiile clinice, ceea ce face practic imposibilă compararea diferitelor medii de cultură. În timp ce aceste criterii oferă rezultate măsurabile pentru o comparație ușoară, schimbarea componentelor utilizate pentru extinderea ASCs poate avea efecte diferite asupra siguranței, eficacității și reproductibilității produselor finale ASC. Examinarea modificărilor transcriptomului, proteomului și secretomului ASCs extinse în diferite medii de cultură este importantă, la fel ca și utilizarea celulelor extinse în condiții diferite în modele preclinice adecvate.,

Tabelul 1. Efectele diferitelor suplimente media asupra ASCs in vitro.
contribuții ale autorului
CD-ul a conceptualizat și a redactat recenzia și a aprobat manuscrisul final. MP a asistat la conceptualizarea revizuirii, a revizuit și a aprobat manuscrisul final. MSP a asistat la conceptualizarea revizuirii, a editat și a aprobat manuscrisul final și a ridicat finanțarea proiectelor în cauză. Toți autorii au citit și aprobat manuscrisul final.,
de Finanțare
Această cercetare și de publicare a acestora este rezultatul de finanțare oferite de Medical Research Council din Africa de Sud în ceea ce privește (a) MRC e Emblematice Premii de Proiect SAMRC-RFA-UFSP-01-2013/CELULELE STEM precum și (b) la fara frecventa Unitate de Cercetare a Celulelor Stem și Terapia. Fundația Națională de cercetare din Africa de Sud a oferit, de asemenea, finanțare.
Declarație privind conflictul de interese
autorii declară că cercetarea a fost efectuată în absența oricăror relații comerciale sau financiare care ar putea fi interpretate ca un potențial conflict de interese.,
mulțumiri
autorii ar dori să mulțumească Dr. Cheryl Tosh pentru asistența editorială.
Chieregato, K., Castegnaro, S., Madeo, D., Astori, G., pegoraro schimbă, M., și Rodeghiero, F. (2011). Factorul de creștere epidermică, factorul de creștere fibroblast de bază și factorul de creștere derivat din trombocite-BB pot înlocui serul bovin fetal și pot concura cu plasma umană bogată în trombocite în expansiunea ex vivo a celulelor stromale mezenchimale derivate din țesutul adipos. Citoterapie 13, 933-943. doi: 10.3109/14653249.2011.,583232
PubMed Abstract | CrossRef Textul Complet | Google Scholar
Mannello, F., și Tonti, G. (2007). Recenzie concisă: nu există descoperiri pentru cultura celulelor stem mezenchimale și embrionare umane: mediu condiționat, strat de alimentare sau fără alimentator; mediu cu ser de vițel fetal, ser uman sau plasmă îmbogățită; mediu fără ser, înlocuitor de ser necondiționat sau formulă ad-hoc? tot ce strălucește nu este aur! Celule Stem 25, 1603-1609. doi: 10.1634 / stemcells.2007-0127
PubMed Abstract | CrossRef Textul Complet | Google Scholar
Selvaggi, T. A., Walker, R. E.,, și Fleisher, T. A. (1997). Dezvoltarea anticorpilor la serul de vițel fetal cu reacții asemănătoare arthus la pacienții infectați cu virusul imunodeficienței umane, cărora li se administrează perfuzii limfocite syngeneice. Sângele 89, 776-779.
PubMed Abstract | Google Scholar
Stedman, T. L. (2006). Dicționarul Medical al lui Stedman. Philadelphia, PA: Lippincott Williams & Wilkins.
Google Scholar