cum funcționează un tampon?un tampon este capabil să reziste la schimbarea pH-ului deoarece cele două componente (acidul conjugat și baza conjugată) sunt prezente în cantități apreciabile la echilibru și sunt capabile să neutralizeze cantități mici de alți acizi și baze (sub formă de H3O+ și OH -) atunci când sunt adăugate la soluție. Pentru a clarifica acest efect, putem lua în considerare exemplul simplu de tampon de acid fluorhidric (HF) și fluorură de sodiu (NaF)., Acidul fluorhidric este un acid slab datorită atracției puternice dintre ionul F relativ mic și protonii solvați (H3O+), care nu îi permite să se disocieze complet în apă. Prin urmare, dacă vom obține HF într-o soluție apoasă, vom stabili următoarele echilibru cu doar o ușoară disociere (Ka(HF) = 6.6×10-4, favorizează puternic reactivi):
\
putem apoi se adaugă și se dizolvă fluorură de sodiu în soluție și se amestecă două până când vom ajunge la volumul dorit și pH-ul la care vrem să-tampon., Când fluorura de sodiu se dizolvă în apă, reacția merge la finalizare, astfel obținem:
\
deoarece Na+ este conjugatul unei baze puternice, nu va avea niciun efect asupra pH-ului sau reactivității tamponului. Adăugarea de \(NaF\) la soluție va crește totuși concentrația de F-în soluția tampon și, în consecință, prin principiul lui Le Chatelier, va duce și la o disociere puțin mai mică a HF în echilibrul anterior. Prezența unor cantități semnificative atât din acidul conjugat, \(HF\), cât și din baza conjugată, F-, permite soluției să funcționeze ca tampon., Această acțiune de tamponare poate fi observată în curba de titrare a unei soluții tampon.
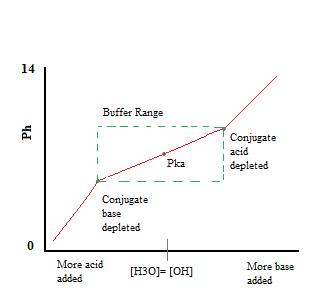
după cum putem vedea, în intervalul de lucru al tamponului. pH-ul se modifică foarte puțin prin adăugarea de acid sau bază. Odată ce capacitatea de tamponare este depășită rata de schimbare a pH-ului sare rapid. Acest lucru se întâmplă deoarece acidul conjugat sau baza a fost epuizată prin neutralizare. Acest principiu implică faptul că o cantitate mai mare de acid conjugat sau bază va avea o capacitate de tamponare mai mare.,în această reacție, baza conjugată, F -, va neutraliza acidul adăugat, H3O+, iar această reacție merge la finalizare, deoarece reacția lui F – cu H3O+ are o constantă de echilibru mult mai mare decât una. (În fapt, constanta de echilibru a reacției scris este doar inversul Ka pentru HF: 1/Ka(HF) = 1/(6.6×10-4) = 1.5×10+3.,) Atâta timp cât există mai mult F – decât H3O+, aproape toată H3O+ va fi consumată și echilibrul se va deplasa spre dreapta, crescând ușor concentrația de HF și scăzând ușor concentrația de F-, dar rezultând aproape nicio modificare a cantității de H3O+ prezentă odată ce echilibrul este restabilit., în această reacție, acidul conjugat, HF, va neutraliza cantitățile adăugate de bază, OH-, iar echilibrul se va deplasa din nou spre dreapta, crescând ușor concentrația de F – în soluție și scăzând ușor cantitatea de HF. Din nou, deoarece majoritatea OH – este neutralizată, se va produce o mică schimbare a pH-ului.aceste două reacții pot continua să alterneze înainte și înapoi, cu mici modificări ale pH-ului.