Rutherford la Manchester, 1907-1919
Ernest Rutherford a descoperit nucleul atomului în 1911. Citim acest lucru în manuale și în scrierile populare. Dar ce înseamnă Această afirmație? Descoperirea geografică înseamnă, de obicei, că cineva vede un loc pentru prima dată. Dar poate descoperirea să fie aceeași pentru un tărâm ascuns de vedere? Nu se poate vedea un atom în acest sens., Deci, acest lucru sugerează că poate povestea descoperirii nucleului a fost mai complicată. Povestea în timp ce se desfășura în laboratorul lui Rutherford de la Universitatea din Manchester se învârtea în jurul oamenilor reali. A implicat frustrări și triumfuri. A implicat muncă grea, nedumerire și inspirație.
 când Rutherford a devenit profesor la Manchester în 1907, a găsit laboratoare moderne atât pentru predare, cât și pentru cercetare. La îndemnul predecesorului său, Arthur Schuster, peste £40,000 a fost ridicat pentru a înzestra programul de fizică. Pentru comparație, salariul generos al lui Rutherford a fost de £1,600/an., Credit: din cartea: laboratoarele fizice ale Universității din Manchester: un record de muncă de 25 de ani de la Universitatea din Manchester, Manchester: la University Press, 1906. AIP Emilio Segrè Visual Archives, colecția de cărți fragile.Rutherford a sosit la Manchester în vara anului 1907, cu câteva luni înainte de începerea mandatului Universității. A fost numit profesor de Fizică Langworthy, succesor al lui Arthur Schuster (1851-1934), care s-a retras la vârsta de 56 de ani pentru a-l recruta pe Rutherford. Schuster a construit o clădire fizică modernă, l-a angajat pe Hans Geiger, Ph. D., (1882-1945) datorită abilității sale experimentale și a înzestrat o nouă poziție în fizica matematică pentru a încheia un program complet de fizică. Rutherford a intrat în centrul lumii fizicii. Cercetătorii au venit la el cu duzina.Rutherford a sosit cu multe întrebări de cercetare în minte. El nu a fost făcut cu puzzle-urile familiilor de decădere din toriu, radiu etc., dar el a fost trece o mare parte din această lucrare la Boltwood, Hahn, și Soddy. Boltwood și Hahn au lucrat cu Rutherford în Manchester, Boltwood în 1909-1910 și Hahn în 1907-1908., Rutherford și-a îndreptat treptat atenția mult mai mult către razele α (alfa), β (beta) și γ (gamma) și către ceea ce ar putea dezvălui despre atom. Adică, el lăsa radio-chimia altora și se îndrepta spre fizică.
când Rutherford a devenit profesor la Manchester în 1907, a găsit laboratoare moderne atât pentru predare, cât și pentru cercetare. La îndemnul predecesorului său, Arthur Schuster, peste £40,000 a fost ridicat pentru a înzestra programul de fizică. Pentru comparație, salariul generos al lui Rutherford a fost de £1,600/an., Credit: din cartea: laboratoarele fizice ale Universității din Manchester: un record de muncă de 25 de ani de la Universitatea din Manchester, Manchester: la University Press, 1906. AIP Emilio Segrè Visual Archives, colecția de cărți fragile.Rutherford a sosit la Manchester în vara anului 1907, cu câteva luni înainte de începerea mandatului Universității. A fost numit profesor de Fizică Langworthy, succesor al lui Arthur Schuster (1851-1934), care s-a retras la vârsta de 56 de ani pentru a-l recruta pe Rutherford. Schuster a construit o clădire fizică modernă, l-a angajat pe Hans Geiger, Ph. D., (1882-1945) datorită abilității sale experimentale și a înzestrat o nouă poziție în fizica matematică pentru a încheia un program complet de fizică. Rutherford a intrat în centrul lumii fizicii. Cercetătorii au venit la el cu duzina.Rutherford a sosit cu multe întrebări de cercetare în minte. El nu a fost făcut cu puzzle-urile familiilor de decădere din toriu, radiu etc., dar el a fost trece o mare parte din această lucrare la Boltwood, Hahn, și Soddy. Boltwood și Hahn au lucrat cu Rutherford în Manchester, Boltwood în 1909-1910 și Hahn în 1907-1908., Rutherford și-a îndreptat treptat atenția mult mai mult către razele α (alfa), β (beta) și γ (gamma) și către ceea ce ar putea dezvălui despre atom. Adică, el lăsa radio-chimia altora și se îndrepta spre fizică. Rutherford a adunat întotdeauna un grup de tineri cercetători strălucitori în jurul lui. În această fotografie de grup din 1910 sunt Ernest Marsden și Hans Geiger. Față și centru sunt profesori Schuster și Rutherford, și centrat în partea din spate este William Kay, steward de laborator talentat și de ajutor. Credit: J. B. Birks, ed.,, Rutherford la Manchester (Londra: Heywood & Co., 1962), vizavi de p. 38. echipa timpurie a lui Rutherford la Manchester a inclus Geiger și William Kay (1879-1961), asistent de laborator junior din 1894. Rutherford a promovat-o pe Kay la laboratory steward în 1908, pentru a gestiona echipamentele de laborator și pentru a-l ajuta în cercetarea sa. În 1957, Kay sa gândit la tinerețe cu Rutherford într-un interviu. Limbajul este ciudat, dar descrierea este la fel de aproape de abordarea lui Rutherford pe cât o obținem., Petentul a fost Samuel Devons (1914-2006), care a fost unul dintre Rutherford ultima studenți în anii 1930.
Rutherford a adunat întotdeauna un grup de tineri cercetători strălucitori în jurul lui. În această fotografie de grup din 1910 sunt Ernest Marsden și Hans Geiger. Față și centru sunt profesori Schuster și Rutherford, și centrat în partea din spate este William Kay, steward de laborator talentat și de ajutor. Credit: J. B. Birks, ed.,, Rutherford la Manchester (Londra: Heywood & Co., 1962), vizavi de p. 38. echipa timpurie a lui Rutherford la Manchester a inclus Geiger și William Kay (1879-1961), asistent de laborator junior din 1894. Rutherford a promovat-o pe Kay la laboratory steward în 1908, pentru a gestiona echipamentele de laborator și pentru a-l ajuta în cercetarea sa. În 1957, Kay sa gândit la tinerețe cu Rutherford într-un interviu. Limbajul este ciudat, dar descrierea este la fel de aproape de abordarea lui Rutherford pe cât o obținem., Petentul a fost Samuel Devons (1914-2006), care a fost unul dintre Rutherford ultima studenți în anii 1930.
 Hans Geiger Rutherford a fost principalul partener în alfa-ray de cercetare din 1907 si 1913. Împreună au dezvoltat mai multe moduri de a detecta razele alfa. Ei au dovedit că razele alfa sunt nuclee de heliu dublu ionizate. Cca. 1908. Credit: AIP Emilio Segre Arhive vizuale, fizica astăzi de colectare.
Hans Geiger Rutherford a fost principalul partener în alfa-ray de cercetare din 1907 si 1913. Împreună au dezvoltat mai multe moduri de a detecta razele alfa. Ei au dovedit că razele alfa sunt nuclee de heliu dublu ionizate. Cca. 1908. Credit: AIP Emilio Segre Arhive vizuale, fizica astăzi de colectare.
Rutherford și Hans Geiger au lucrat îndeaproape în 1907 și 1908 la detectarea și măsurarea particulelor α., Dacă ar fi folosit particule α pentru a sonda atomul, ar fi trebuit mai întâi să știe mai multe despre aceste particule și comportamentul lor. Rutherford a încercat și nu a reușit înapoi la McGill să numere particulele α.un an mai târziu, în Manchester, el și Geiger au reușit cu două metode de observare a particulelor α. Prima metodă a implicat scintilații excitate de particule α pe un strat subțire de sulfură de zinc. Ei le-au observat printr-un microscop și au numărat scintilațiile în diferite unghiuri de dispersie., De asemenea, au dezvoltat un „electrometru” care ar putea demonstra trecerea unei particule α individuale către un public larg. Instrumentul, care a evoluat în „contorul Geiger”, avea un cilindru metalic parțial evacuat, cu un fir în centrul său. Au aplicat o tensiune între cilindru și sârmă suficient de mare pentru a scânteia. Au admis particule α printr-o fereastră mică subțire, unde aceste particule s-au ciocnit cu gaze, producând ioni de gaz. Acestea s-au ciocnit apoi cu alte molecule și au produs mai mulți ioni și așa mai departe., Fiecare particulă α a produs o cascadă de ioni, care a descărcat parțial cilindrul și a indicat trecerea unei particule α. Geiger și Rutherford au publicat mai multe articole în 1908 și 1909 despre aceste metode și utilizarea lor.Rutherford i-a scris lui Henry Bumstead (1870-1920), un fizician American, la 11 iulie 1908:
Geiger este un om bun și a lucrat ca un sclav. N-aș fi putut găsi timp pentru corvoada înainte de a ne-am lucrurile merg în stil bun. În cele din urmă totul a mers bine, dar împrăștierea este diavolul. Tubul nostru a funcționat ca un farmec și am putea obține cu ușurință o aruncare de 50 mm., pentru fiecare particulă. … Geiger este un demon la locul de muncă de numărare scintilații și ar putea conta la intervale de timp pentru o noapte întreagă, fără a deranja echanimitatea lui. M-am retras viguros și m-am retras după două minute. (Citat în Eva, p.180.deși Rutherford bănuia încă din 1906 că particulele α erau atomi de heliu deposedați de electronii lor, el a cerut un standard ridicat de dovadă. Un fel de experiment nu a fost suficient. Un fel de detector nu a fost suficient. Voia mai multe dovezi., Pentru aceasta, Rutherford dorea „tensiuni mari” și electromagneți mari pentru a devia particulele α, Dar această metodă nu era încă coaptă. Stewardul de laborator William Kay a reamintit în interviul citat de istorie orală că Rutherford în 1908 a insistat că sunt necesare câmpuri electrice și magnetice puternice pentru a măsura mai direct sarcina și masa particulelor α și β:
Kay a spus că Rutherford dorea un magnet mare, răcit cu apă, dar că „l-a scăpat ca pe un tort fierbinte” când a aflat costul acestuia. Așa că avea nevoie de o nouă linie de atac. Noua linie a fost foarte simplă, o procedură chimică amestecată cu fizica., Pentru această lucrare, Rutherford l-a recrutat pe Thomas Royds (1884-1955), care și-a câștigat diploma de Fizică în 1906. Au colectat particule α într-un tub de sticlă sigilat, le-au comprimat și au trecut printr-o scânteie electrică. Ei au studiat lumina emisă într-un spectroscop și au descoperit că este identică cu spectrul heliului. În câteva luni, Rutherford a primit Premiul Nobel pentru Chimie, „pentru investigațiile sale privind dezintegrarea elementelor și chimia substanțelor radioactive., Rutherford și Royds au stabilit identitatea și proprietățile primare ale particulelor α. Rutherford și-a îndreptat apoi atenția spre utilizarea lor pentru a sonda atomul.toamna anului 1908 a început o serie importantă de cercetări. Geiger a trecut fascicule de particule α prin aur și alte folii metalice, folosind noile tehnici de detectare pentru a măsura cât de mult aceste fascicule au fost dispersate de atomii din folii. Geiger a crezut că Ernest Marsden (1889-1970), un student de 19 ani în fizica onorurilor, era gata să ajute la aceste experimente și ia sugerat lui Rutherford., Deoarece Rutherford a împins adesea studenții din anul al treilea în cercetare, spunând că acesta este cel mai bun mod de a învăța despre fizică, el a fost de acord cu ușurință.
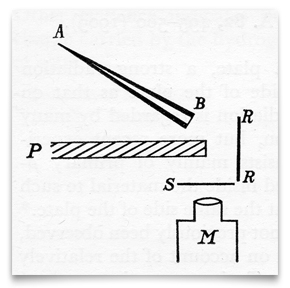 această schiță, din articolul lui Geiger și Marsden din 1909, arată un tub conic de sticlă plin de” emanație de radiu ” (radon), închis la B cu un panou subțire de mică. Aceasta a fost sursa lor de particule alfa (α). S a fost un ecran cu sulfură de zinc, care a scintilat când a fost lovit de o particulă α. P a fost un ecran de plumb, care a blocat orice particule α să călătorească direct la ecranul zinc-sulfură., RR A fost o folie (sau folii) din diferite metale (inclusiv aur) care „reflectă difuz” particulele α incidente. Geiger și Marsden observat rezultate scintillations prin observarea la microscop, M. Credit: H. Geiger și E. Marsden, „Pe o Reflexie Difuză ale α-Particule,” Proceedings of the Royal Society,1909, 82:495-500.Geiger și Marsden au început cu dispersie cu unghi mic și au încercat diferite grosimi de folii, căutând relații matematice între dispersie și grosimea foliei sau numărul de atomi traversați., Marsden și-a amintit mai târziu că Rutherford i-a spus în mijlocul acestor experimente: „vedeți dacă puteți obține un efect al particulelor alfa reflectate direct de pe o suprafață metalică.”(Raportat de Marsden în Birks, 1962, p. 8). Marsden se îndoia că Rutherford se aștepta la împrăștierea particulelor α, dar după cum scria Marsden
această schiță, din articolul lui Geiger și Marsden din 1909, arată un tub conic de sticlă plin de” emanație de radiu ” (radon), închis la B cu un panou subțire de mică. Aceasta a fost sursa lor de particule alfa (α). S a fost un ecran cu sulfură de zinc, care a scintilat când a fost lovit de o particulă α. P a fost un ecran de plumb, care a blocat orice particule α să călătorească direct la ecranul zinc-sulfură., RR A fost o folie (sau folii) din diferite metale (inclusiv aur) care „reflectă difuz” particulele α incidente. Geiger și Marsden observat rezultate scintillations prin observarea la microscop, M. Credit: H. Geiger și E. Marsden, „Pe o Reflexie Difuză ale α-Particule,” Proceedings of the Royal Society,1909, 82:495-500.Geiger și Marsden au început cu dispersie cu unghi mic și au încercat diferite grosimi de folii, căutând relații matematice între dispersie și grosimea foliei sau numărul de atomi traversați., Marsden și-a amintit mai târziu că Rutherford i-a spus în mijlocul acestor experimente: „vedeți dacă puteți obține un efect al particulelor alfa reflectate direct de pe o suprafață metalică.”(Raportat de Marsden în Birks, 1962, p. 8). Marsden se îndoia că Rutherford se aștepta la împrăștierea particulelor α, dar după cum scria Marsden
… a fost una dintre acele „bănuieli” care ar putea fi observate și că, în orice caz, teritoriul vecin al acestui pământ Tom Tiddler ar putea fi explorat prin recunoaștere., Rutherford a fost vreodată gata să întâlnească neașteptatul și să-l exploateze, unde era favorabil, dar știa și când să se oprească în astfel de excursii. (Birks, 1962, p. 8)
aceasta a fost abordarea jucăușă a lui Rutherford în acțiune. Studenții săi și alții au încercat ideile sale, dintre care multe erau fundături. Această idee de a căuta backscattering de particule α, Cu toate acestea, plătit., Rutherford a scris:
Experiment, regizat de disciplinat imaginatia ori de un individ sau, mai bine încă, de un grup de persoane de variate mentale outlook, este capabil de a obține rezultate care depășesc imaginația singur de cel mai mare filozof. (Citat în Eve, 1939, Frontmatter)
cândva mai târziu, în 1908 sau 1909, Marsden a spus că și-a raportat rezultatele lui Rutherford. Rutherford și-a amintit acest lucru puțin diferit:
îmi amintesc …mai târziu Geiger vine la mine cu mare entuziasm și spune, ” Am fost capabili de a obține unele dintre α-particule vine înapoi…,”A fost cel mai incredibil eveniment care mi s-a întâmplat vreodată în viața mea. A fost aproape incredibil ca și cum ai tras un cartuș de 15 inch într-o bucată de hârtie absorbantă și s-a întors și te-a lovit. (Rutherford, 1938, P. 68)
memoria umană este eronată. Indiferent dacă Marsden sau Geiger i-au spus lui Rutherford, efectul a fost același. Rutherford a spus că ar trebui să pregătească o publicație din această cercetare, pe care au prezentat-o în mai 1909. Mai mult decât atât, acest lucru a început Rutherford gândire spre ceea ce în cele din urmă, aproape doi ani mai târziu, el a publicat ca o teorie a atomului.,
ce făcea Rutherford pentru restul anului 1909 și pentru tot anul 1910? În primul rând, prietenul său apropiat Boltwood a fost în Manchester pentru anul universitar, lucrând cu Rutherford la produsele de dezintegrare radioactivă a radiului. El a fost, de asemenea, revizuirea și vorbind despre ideile anterioare despre structura atomică. Cel mai important, el a luat sistematic fenomenul de împrăștiere a particulelor α și a testat fiecare piesă. Rutherford nu a avut ideea sa îndrăzneață — atomul nuclear — instantaneu, dar a ajuns la ea treptat, luând în considerare problema din multe părți.,în toamna anului 1910 l-a adus pe Marsden înapoi la Manchester pentru a finaliza testarea experimentală riguroasă a ideilor sale cu Geiger. Ei au restabilit ratele de emisie și intervalele de particule α de surse radioactive și au reexaminat analizele lor statistice. Rutherford a încercat să împace împrăștierea rezultatelor cu diferite modele atomice, mai ales de J. J. Thomson, în care pozitiv de energie electrică a fost considerat ca fiind dispersate uniform în întreaga sferă a atomului.
 o pagină a notelor brute timpurii, nedatate (1910 sau 1911) ale lui Rutherford., Primele câteva rânduri au citit: „teoria structurii atomului. Să presupunem că atomul este format din + acuze la centrul & de – taxa fel de electron distribuite în întreaga sferă de rază r.” Apoi, el a bruscat idei despre calculul forței de deformare asupra unei particule încărcate, care trece aproape de acest acuzat de centru. Credit: J. B. Birks, ed., Rutherford la Manchester (Londra: Heywood & Co., 1962), p. 70.
o pagină a notelor brute timpurii, nedatate (1910 sau 1911) ale lui Rutherford., Primele câteva rânduri au citit: „teoria structurii atomului. Să presupunem că atomul este format din + acuze la centrul & de – taxa fel de electron distribuite în întreaga sferă de rază r.” Apoi, el a bruscat idei despre calculul forței de deformare asupra unei particule încărcate, care trece aproape de acest acuzat de centru. Credit: J. B. Birks, ed., Rutherford la Manchester (Londra: Heywood & Co., 1962), p. 70.
la un moment dat în iarna 1910-1911, Rutherford a elaborat ideea de bază a unui atom cu un „centru încărcat”.,”După cum au subliniat Geiger și Marsden în articolul lor din 1909:
Dacă se ia în considerare viteza și masa mare a particulei α, pare surprinzător faptul că unele dintre particulele α, după cum arată experimentul, pot fi transformate într-un strat de 6 x 10-5 cm. de aur printr-un unghi de 90°, și chiar mai mult. Pentru a produce un efect similar printr-un câmp magnetic, ar fi necesar un câmp enorm de 109 unități absolute. (Birks, p., Rutherford a concluzionat în lucrarea sa din mai 1911 că o astfel de abatere remarcabilă în calea unei particule încărcate masive ar putea fi obținută numai dacă cea mai mare parte a masei, să zicem, a unui atom de aur și cea mai mare parte a încărcăturii sale ar fi concentrată într-un corp central foarte mic. Notă: În acest moment în 1911, Rutherford nu a numit acest lucru un ” nucleu.”
aveți nevoie de Flash Player instalat pentru a asculta acest clip audio.,primul anunț public al teoriei nucleare de către Rutherford a fost făcut la o întâlnire a Societății Literare și filosofice din Manchester și ne-a invitat pe tinerii băieți să mergem la întâlnire. A spus că are de spus niște lucruri interesante și s-a gândit că am vrea să le auzim. Nu știam despre ce era vorba în acel moment. Persoanele în vârstă din laborator au făcut-o, desigur Geiger și Marsden știau pentru că făceau deja experimentele. De fapt, dacă nu au făcut unele care erau suficiente pentru a fi decisive, Rutherford nu a menționat-o niciodată public., Și, desigur, Darwin știa despre asta mult mai devreme. Dar asta trebuie să fi fost la începutul anului 1911, și ne-am dus la întâlnire și ne-a spus. Și el a menționat atunci că există unele dovezi experimentale care au fost obținute de Geiger și Marsden. El nu a spus, din câte îmi amintesc, mai multe despre rezultate decât că au fost destul de decisive. Și, așa cum am mai spus, nu ar fi făcut niciodată un anunț public de acest fel dacă nu ar fi avut dovezi bune., Și aceasta este una dintre caracteristicile care trece prin toată munca lui Rutherford, în special toată munca sa până la sfârșitul perioadei Manchester. Dacă vă uitați la unele dintre lucrările sale din primele zile-îl numesc pe McGill primele zile-era destul de convins că particulele alfa erau atomi de heliu, dar nu a spus niciodată asta în acele cuvinte. El a spus întotdeauna că au fost fie atomi de heliu sau molecule de hidrogen sau poate că el poate fi spus altceva de această greutate., A fost destul de caracteristic pentru el că el nu ar spune un lucru a fost atât de excepția cazului în care el a avut dovezi experimentale pentru că într-adevăr l-au mulțumit.
de fapt, Rutherford a fost extrem de precaut în a trage concluzii despre acest centrală de incarcare: „Un calcul simplu arată că atomul trebuie să fie un loc de un câmp electric intens în scopul de a produce astfel o mare deflexion la o singură întâlnire.”(Birks, p. 183). El a elaborat rapid și aproximativ că mai multe relații cantitative ar trebui să fie adevărate dacă această teorie de bază ar fi corectă., În primul rând, numărul de particule α împrăștiate printr-un unghi dat trebuie să fie proporțional cu grosimea foliei. În al doilea rând, acest număr ar trebui să fie proporțional cu pătratul încărcăturii nucleare. În cele din urmă, ar trebui să fie invers proporțional cu a patra putere a vitezei particulei α. Aceste trei idei au stabilit programul experimental al lui Geiger și Marsden pentru anul următor.
aveți nevoie de Flash Player instalat pentru a asculta acest clip audio.,interesul lui Rutherford a fost apoi aproape în întregime în cercetare. El a făcut foarte puțin de predare în McGill. A fost profesor de cercetare. Presupun că a ținut câteva prelegeri, dar ar fi fost foarte puține. Și interesul său a fost destul de natural pe partea de cercetare. El a dat câteva prelegeri, dar prelegeri elementare, genul de lucru pe care te-ai aștepta ca un om să știe înainte de a veni la universitate. Erau prelegerile inginerilor. Erau foarte gălăgioși și Rutherford îi putea ține sub control., Nu a fost, probabil, doar un alt om în departamentul care ar fi putut face acest lucru, și el (Rutherford?) le-a plăcut pentru că a reușit să le arate experimentele foarte interesante pe care le poate efectua în cursurile elementare.de multe ori mi s-a spus că Rutherford a fost un lector prost. N-am mai auzit asemenea prostii. Este destul de adevărat că, ocazional, ar fi un pic plictisitor, un pic amestecat, dar asta a fost doar în ocazii foarte rare. Au fost și alte ocazii când a fost foarte stimulant. A fost un entuziasm extraordinar despre el.,Rutherford a distrat posibilitatea ca Centrul încărcat să fie negativ. Sună ciudat astăzi, deci ce a făcut-o rezonabilă? În primul rând, nu a fost foarte diferit de modelul lui Thomson. În al doilea rând, din moment ce Rutherford știa că particulele α poartă o sarcină dublă+, el a crezut că aceasta ar putea acționa în același mod în care soarele o face pe o cometă care se apropie de ea. Aceasta ar praștie particula α în jurul și înapoi spre sursa sa. El a considerat, de asemenea, un model aproape uitat sugerat de fizicianul Japonez Hantaro Nagaoka (1865-1950) — Modelul Saturnian., Nagaoka și Rutherford au fost în contact în 1910 și 1911, iar Rutherford a menționat modelul lui Nagaoka de „o masă centrală care atrage înconjurați de inele de electroni rotativi” (Birks, p. 203). Rezultatul final al acestei lucrări critice Rutherford a fost totuși anunțul lui Rutherford că dacă atomul era un disc sau o sferă și, într-adevăr, dacă sarcina centrală era pozitivă sau negativă, nu ar afecta calculele. Rutherford a fost întotdeauna atent să nu pretindă mai mult decât rezultatele sale ar putea susține.,
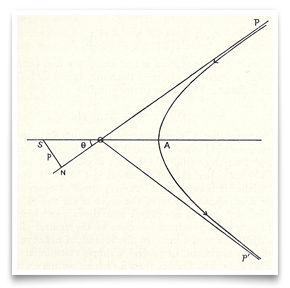 în celebra lucrare a lui Rutherford din mai 1911 despre împrăștierea particulelor alfa prin folie de aur, el a inclus această schiță a căii hiperbolice a unei particule. Credit: E. Rutherford,” împrăștierea particulelor α și β prin materie și structura materiei”, revista filosofică, 1911, 21:669-688.
în celebra lucrare a lui Rutherford din mai 1911 despre împrăștierea particulelor alfa prin folie de aur, el a inclus această schiță a căii hiperbolice a unei particule. Credit: E. Rutherford,” împrăștierea particulelor α și β prin materie și structura materiei”, revista filosofică, 1911, 21:669-688.
Rutherford a văzut posibile teste ale naturii încărcăturii centrale. Absorbția particulelor β, a spus el, ar trebui să fie diferită cu un centru negativ față de unul pozitiv., Un centru pozitiv ar explica viteza mare pe care particulele α o ating în timpul emisiei de elemente radioactive. Dar acestea erau doar indicii.
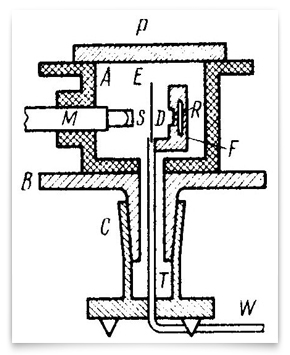 Această schemă reprezintă rafinat experimente de 1912-13 efectuate de Geiger și Marsden. R a fost sursa particulelor alfa, e a fost folia de aur, iar m a fost microscopul rotativ în jurul unei axe verticale centrate pe folia de aur. Particulele alfa din sursă au trecut prin diafragma D, au fost împrăștiate de folie și au fost observate ca scintilații pe ecranul S., Geiger și Marsden au observat unghiurile particulelor împrăștiate prin rotirea ansamblului microscop-ecran. Credit: H. Geiger și E. Marsden,” legile deflexiei particulelor α prin unghiuri mari”, revista filosofică, 1913, 25:604-623.Geiger și Marsden au lucrat într-adevăr sistematic prin implicațiile testabile ale ipotezei de încărcare centrală a lui Rutherford. Prima publicare majoră a rezultatelor lor a fost în limba germană în Proceedings of Vienna Academy of Sciences (Sitzungberichte der Wiener Akademie der Wissenschaften) în 1912., Această versiune de 30 de pagini a fost urmată de una în limba engleză în 1913 în revista filosofică: „legile deflexiei particulelor α prin unghiuri mari” versiunea în limba engleză este cea mai cunoscută. Mici diferențe între cele două l-au determinat pe un istoric să sugereze că Rutherford a decis în favoarea unui centru încărcat pozitiv până în August 1912 (Trenn, 1974). Rutherford și alți membri ai echipei, mai ales Charles Galton Darwin (1887-1962), H. G. J. Moseley (1887-1915), și Niels Bohr (1885-1962) proeminent în final stabilirea Rutherford nuclear al atomului.,
Această schemă reprezintă rafinat experimente de 1912-13 efectuate de Geiger și Marsden. R a fost sursa particulelor alfa, e a fost folia de aur, iar m a fost microscopul rotativ în jurul unei axe verticale centrate pe folia de aur. Particulele alfa din sursă au trecut prin diafragma D, au fost împrăștiate de folie și au fost observate ca scintilații pe ecranul S., Geiger și Marsden au observat unghiurile particulelor împrăștiate prin rotirea ansamblului microscop-ecran. Credit: H. Geiger și E. Marsden,” legile deflexiei particulelor α prin unghiuri mari”, revista filosofică, 1913, 25:604-623.Geiger și Marsden au lucrat într-adevăr sistematic prin implicațiile testabile ale ipotezei de încărcare centrală a lui Rutherford. Prima publicare majoră a rezultatelor lor a fost în limba germană în Proceedings of Vienna Academy of Sciences (Sitzungberichte der Wiener Akademie der Wissenschaften) în 1912., Această versiune de 30 de pagini a fost urmată de una în limba engleză în 1913 în revista filosofică: „legile deflexiei particulelor α prin unghiuri mari” versiunea în limba engleză este cea mai cunoscută. Mici diferențe între cele două l-au determinat pe un istoric să sugereze că Rutherford a decis în favoarea unui centru încărcat pozitiv până în August 1912 (Trenn, 1974). Rutherford și alți membri ai echipei, mai ales Charles Galton Darwin (1887-1962), H. G. J. Moseley (1887-1915), și Niels Bohr (1885-1962) proeminent în final stabilirea Rutherford nuclear al atomului.,  tânărul Henry G. J. Moseley, în Balliol-Trinity de Laborator, Oxford, ca. 1910. Mai târziu în acel an, Moseley a început cercetarea în laboratorul lui Rutherford din Manchester. Cariera sa strălucitoare a fost scurtată în luptă în Primul Război Mondial. Credit: Universitatea din Oxford, Muzeul de Istorie a științei, curtoazie AIP Emilio Segrè Visual Archives, colecția Physics Today.
tânărul Henry G. J. Moseley, în Balliol-Trinity de Laborator, Oxford, ca. 1910. Mai târziu în acel an, Moseley a început cercetarea în laboratorul lui Rutherford din Manchester. Cariera sa strălucitoare a fost scurtată în luptă în Primul Război Mondial. Credit: Universitatea din Oxford, Muzeul de Istorie a științei, curtoazie AIP Emilio Segrè Visual Archives, colecția Physics Today.
„Marele Război” a perturbat total munca în departamentul Rutherford din Manchester. Bohr s-a întors în Danemarca. Marsden a acceptat o profesie în Noua Zeelandă. Moseley a murit în Bătălia de la Gallipoli., James Chadwick (1891-1974), care lucra cu Geiger la Universitatea Tehnică din Berlin când a izbucnit războiul, a petrecut câțiva ani internați în lagărul Ruhleben pentru prizonieri de război. Și alți studenți au plecat la război, iar Rutherford a dedicat o energie considerabilă mobilizării științei pentru efortul de război și în special tehnicilor anti-submarine.
 Niels Bohr a lucrat pentru prima dată cu Rutherford la
Niels Bohr a lucrat pentru prima dată cu Rutherford la
Manchester în 1912. Această fotografie prezintă tinerii Niels și Margrethe Bohr, ca., 1914, când Bohr i-a succedat lui Charles Galton Darwin ca cititor Schuster în Fizică Matematică la Manchester. Credit: AIP Emilio Segre Visual Archives, Margrethe Bohr Collection.în acest context distras, Rutherford și administratorul său de laborator, William Kay, au început în 1917 să exploreze trecerea particulelor α prin hidrogen, azot și alte gaze. Când Marele Război s-a încheiat, Ernest Marsden a ajutat pe scurt observațiile obositoare de scintilație care au oferit indicii despre natura nucleului. Rutherford a raportat rezultatele tentative ale acestor experimente extinse în 1919., Rutherford a plasat o sursă de radiu C (bismut-214) într-un sigilabil alamă container, montate astfel încât poziția de sursă ar putea fi schimbat și diferite gaze ar putea fi introdusă sau un vid de produse, după cum doriți. Particulele α au traversat interiorul containerului și au trecut printr-o fantă, acoperită de o placă de argint sau alt material, și au lovit un ecran cu sulfură de zinc, unde s-a observat o scintilație într-o cameră întunecată. Când hidrogenul gazos a fost introdus în recipient și s-a avut grijă să absoarbă particulele α înainte de a lovi ecranul, s-au observat încă scintilații., Rutherford a afirmat că, pe măsură ce particulele α traversau hidrogenul gazos, se ciocneau ocazional cu nucleele de hidrogen. După cum scria Rutherford, acest lucru a produs „atomi de hidrogen rapid”, care au fost în mare parte proiectați înainte în direcția mișcării inițiale a particulelor α.Rutherford a avut câteva întrebări subtile în minte în timpul acestor experimente, în cea mai mare parte preocupate de natura nucleului., El a cerut colegul lui Darwin pentru a analiza aceste coliziuni, bazate pe o teorie simplă de coliziuni elastice între punctul de nuclee respins potrivit unui pătrat invers lege, α particule care transportă o încărcătură de 2 ori de un electron (și de semn opus) și nuclee de hidrogen de 1 ori. Darwin a descoperit că toate particulele α care se apropie de 2, 4×10-13 cm ar produce un ” atom de hidrogen rapid.”Această teorie simplă, totuși, a prezis mult mai puțini atomi de hidrogen accelerați decât au fost observați în experimente.,Rutherford a respins explicațiile acestei variații bazate pe sarcini diferite asupra particulelor sau alte legi decât legile pătrate inverse. Mai degrabă, el a concluzionat că, pentru distanțe de ordinul diametrului electronului, ” structura nucleului de heliu nu mai poate fi privită ca un punct…”. El a afirmat că nucleul de heliu (particula α) are o structură complexă de patru nuclee de hidrogen plus doi electroni încărcați negativ. (Am spune că este compus din doi protoni.,) Rutherford a concluzionat că deformarea nucleelor complexe în timpul coliziunilor a fost o explicație mai probabilă, variația forțelor dintre nuclee variind într-un mod complex în apropierea apropiată.având în vedere forțele intense aduse în joc în astfel de coliziuni, nu ar fi surprinzător dacă nucleul de heliu s-ar rupe. Nu s-a observat nicio dovadă a unei astfel de dezintegrări, indicând faptul că nucleul de heliu trebuie să fie o structură foarte stabilă.,trebuie să ne amintim că Rutherford nu a putut observa direct structura nucleului, deci concluziile sale au fost tentative. Cu toate acestea, el a luat în considerare în mod deschis posibilitățile unui nucleu complex, capabil de deformare și chiar de posibilă dezintegrare. Aceste gânduri au modelat această perioadă intensă de Cercetări Experimentale.