configurația electronilor
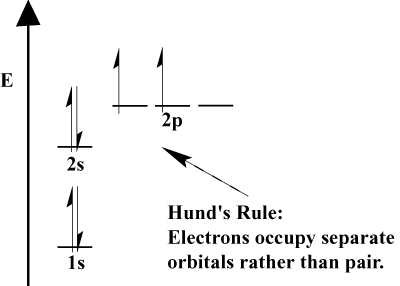
electronii dintr-un atom își umplu orbitalii atomici conform principiului Aufbau; „Aufbau”, în Germană, înseamnă „construirea.”Principiul Aufbau, care încorporează principiul excluderii Pauli și regula lui Hund prevede câteva reguli simple pentru a determina ordinea în care electronii umplu orbitalii atomici:
- electronii umplu întotdeauna orbitalii cu energie inferioară mai întâi. 1S este umplut înainte de 2s, și 2S înainte de 2p.,
- principiul excluderii Pauli afirmă că doi electroni dintr-un anumit atom nu pot avea numere cuantice identice. În funcție, acest principiu înseamnă că, dacă doi electroni ocupă același orbital, trebuie să aibă spin opus.
- regula lui Hund afirmă că atunci când un electron se alătură unui atom și trebuie să aleagă între două sau mai multe orbite de aceeași energie, electronul va prefera să intre într-un orbital gol decât unul deja ocupat., Pe măsură ce mai mulți electroni sunt adăugați la atom, acești electroni tind să umple orbitalii de aceeași energie înainte de a se împerechea cu electronii existenți pentru a umple orbitalii.
Valență și Electroni de Valență
ultraperiferice orbital coajă de un atom se numește valence shell, și electronii din valence shell sunt electroni de valență. Electronii de valență sunt cei mai mari electroni de energie dintr-un atom și, prin urmare, sunt cei mai reactivi. În timp ce interior electroni (nu cei din valence shell) de obicei nu participă la legături chimice și reacții, electronii de valență pot fi câștigate, pierdute, sau comune pentru a forma legături chimice., Din acest motiv, elementele cu același număr de electroni de valență tind să aibă proprietăți chimice similare, deoarece tind să câștige, să piardă sau să împartă electroni de valență în același mod. Tabelul Periodic a fost conceput cu această caracteristică în minte. Fiecare element are un număr de electroni de valență egal cu numărul grupului său din tabelul Periodic.
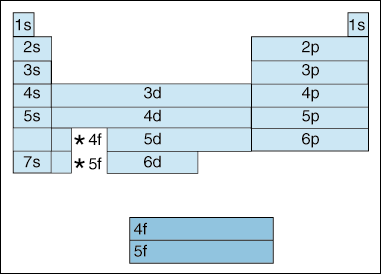
Acest tabel ilustrează o serie de interesante, și complică, caracteristici de electroni de configurare., în primul rând, pe măsură ce electronii devin mai mari în energie, are loc o schimbare. Până acum, am spus că, pe măsură ce numărul cuantic al principiului, crește, la fel și nivelul de energie al orbitalului. Și, așa cum am menționat mai sus în principiul Aufbau, electronii umplu orbitalii de energie mai mici înainte de a umple orbitalii de energie mai mari. Cu toate acestea, diagrama de mai sus arată clar că orbitalul 4S este umplut înainte de orbitalul 3D., Cu alte cuvinte, odată ce vom ajunge la principiul cuantic numărul 3, cea mai mare subshells dintre cele mai mici numere cuantice eclipsa de energie cel mai mic subshells mai mare de numere cuantice: 3d este de energie mai mare decât 4s.
în al Doilea rând, cele de mai sus indică o metodă de a descrie un element în funcție de configurația electroni. Pe măsură ce vă deplasați de la stânga la dreapta peste tabelul periodic, diagrama de mai sus arată ordinea în care orbitalii sunt umplute. Dacă am fi defalcat de fapt diagrama de mai sus în grupuri, mai degrabă decât blocurile pe care le avem, ar arăta cât de exact câți electroni are fiecare element., De exemplu, elementul de hidrogen, situat în colțul din stânga sus al tabelului periodic, este descris ca 1s1, cu S care descrie orbitalul care conține electroni și 1 care descrie câți electroni locuiesc în acel orbital. Litiul, care se află pe tabelul periodic chiar sub hidrogen, ar fi descris ca fiind 1s22s1. Configurațiile electronice ale primelor zece elemente sunt prezentate mai jos (rețineți că electronii de valență sunt electronul din cel mai înalt înveliș de energie, nu doar electronii din cel mai înalt subshell de energie).,

Octeți Regula
discuția Noastră de electron de valenta configurații ne conduce la una dintre cardinalul principiile de legături chimice, octeți regula. Regula octetului afirmă că atomii devinîn special stabile atunci când cojile lor de valență câștigă un complement complet de electroni de valență. De exemplu, în cele de mai sus, heliul (He) și neonul (Ne) au cochilii de valență exterioare care sunt complet umplute, deci nici nu are tendința de a câștiga sau de a pierde electroni., Prin urmare, heliul și neonul, două dintre așa-numitele gaze nobile, există în formă atomică liberă și nu formează de obicei legături chimice cu alți atomi. cu toate acestea, majoritatea elementelor nu au o cochilie exterioară completă și sunt prea instabile pentru a exista ca atomi liberi. În schimb, ei caută să-și umple cochilii de electroni exteriori formând legături chimice cu alți atomi și, prin urmare, să atingă configurația gazului nobil. Un element va tinde să ia calea cea mai scurtă pentru a obține configurația gazului nobil, indiferent dacă aceasta înseamnă câștigarea sau pierderea unui electron., De exemplu, sodiul (Na), care are un singur electron în orbitalul său exterior 3s, poate pierde acel electron pentru a atinge configurația electronică a neonului. Clorul, cu șapte electroni de valență, poate obține un electron pentru a atinge configurația argonului. Când două elemente diferite au aceeași configurație de electroni, ele sunt numite izoelectronice.
diamagnetismul și paramagnetismul
configurația electronică a unui atom are, de asemenea, consecințe asupra comportamentului său în raport cu câmpurile magnetice. Un astfel de comportament depinde de numărul de electroni pe care un atom îi are care sunt perechi de spin., Amintiți-vă că regula lui Hund și principiul excluderii Pauli se combină pentru a dicta că orbitalii unui atom se vor umple pe jumătate înainte de a începe să se umple complet și că atunci când se umple complet cu doi electroni, acești doi electroni vor avea rotiri opuse.
un atom cu toate orbitele sale umplute și, prin urmare, toți electronii săi împerecheați cu un electron de spin opus, vor fi foarte puțin afectați de câmpurile magnetice. Astfel de atomi sunt numiți diagmetici. În schimb, atomii paramagnetici nu au toți electronii lor spin-pereche și sunt afectați de câmpuri magnetice., Există grade de paramagnetism, deoarece un atom ar putea avea un electron nepereche sau ar putea avea patru.