Electron Kokoonpano
elektronit atomin täyttää sen atomi orbitaalit mukaan Aufbau Periaate; ”Aufbau,” saksaksi tarkoittaa ”rakentaa.”Se Aufbau-Periaate, joka sisältää Paulin kieltosääntö ja Hund on Sääntö määrää muutamia yksinkertaisia sääntöjä, voit määrittää järjestyksen, jossa elektronit täyttää atomic orbitaalit:
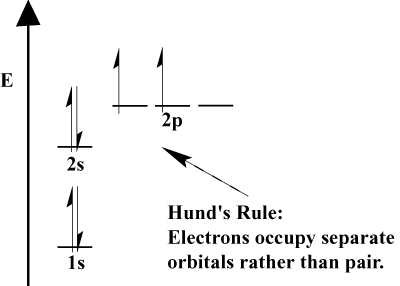
- Elektronit aina täyttää orbitaalien vähemmän energiaa ensin. 1s täytetään ennen 2s, ja 2s ennen 2p.,
- Pauli Exclusion-periaatteen mukaan kahdella elektronilla tietyn atomin sisällä ei voi olla identtisiä kvanttilukuja. Vuonna toiminto, tämä periaate tarkoittaa sitä, että jos kaksi elektronia miehittää saman kiertoradan, ne on vastakkainen spin.
- Hund on Sääntö toteaa, että kun elektroni liittyy atomin ja on valita kaksi tai enemmän orbitaalit sama energia, elektroni mieluummin syöttää tyhjän silmäkuopan pikemminkin kuin yksi jo käytössä., Kun atomiin lisätään enemmän elektroneja, nämä elektronit pyrkivät puolittamaan saman energian orbitaaleja ennen kuin ne liittyvät olemassa oleviin elektroneihin täyttääkseen orbitaalit.
Sijoitus ja Valence Elektronit
syrjäisimpien kiertoradan kuori atomi on nimeltään sen valence kuori, ja elektroneja valence shell ovat valence elektroneja. Valenssielektronit ovat atomin korkeimpia energia-elektroneja ja siten reaktiivisimpia. Kun sisäinen elektroneja (niitä ei valence shell) eivät yleensä osallistu kemiallisten liimaus ja reaktioita, valence elektronit voivat olla saaneet, kadonneet, tai jaetun lomakkeen kemiallisia sidoksia., Tästä syystä elementit, joilla on sama määrä valence elektronit ovat yleensä samankaltaiset kemialliset ominaisuudet, koska niillä on taipumus saada, menettää, tai jakaa valence elektroneja samalla tavalla. Jaksollinen järjestelmä suunniteltiin tätä ominaisuutta silmällä pitäen. Jokainen elementti on useita valence elektroneja yhtä suuri kuin sen ryhmän numero Jaksollisen.
Tämä taulukko esittää useita mielenkiintoisia, ja vaikeuttaa, ominaisuudet electron kokoonpano.,
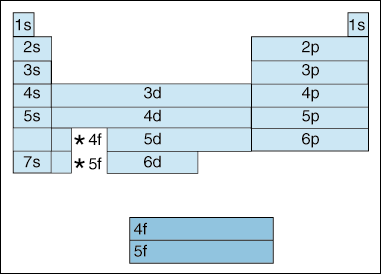
ensin elektronien kasvaessa energiassa tapahtuu muutos. Tähän asti olemme sanoneet, että periaatteena kvanttiluku kasvaa, samoin kiertoradan energiataso. Ja kuten edellä Aufbau-periaatteessa totesimme, elektronit täyttävät matalamman energian orbitaalit ennen kuin ne täyttävät korkeamman energian orbitaalit. Yllä oleva kaavio osoittaa kuitenkin selvästi, että 4s-orbitaali täytetään ennen 3D-orbitaalia., Toisin sanoen, kun pääsemme periaate quantum numero 3, korkein subshells alemman quantum numerot eclipse energian alin subshells korkeampi quantum numerot: 3d on korkeampi energia kuin 4s.
Toiseksi, edellä osoittaa, menetelmä kuvataan elementin mukaan sen elektronikonfiguraatio. Kun siirryt vasemmalta oikealle jaksollisen järjestelmän poikki, yllä oleva kaavio osoittaa, missä järjestyksessä orbitaalit täytetään. Jos olisimme itse asiassa hajottaa edellä kaavio ryhmiin eikä lohkot meillä on, se osoittaisi, kuinka monta elektroneja kukin elementti on., Esimerkiksi osa vetyä, joka sijaitsee ylimmässä vasemmalla alakulmassa jaksollisen, on kuvattu 1s1, s kuvataan jonka kiertoradan sisältää elektroneja ja 1 kuvataan, kuinka monta elektronia asuvat, että kiertoradan. Litiumia, joka sijaitsee jaksollisessa järjestelmässä hieman vedyn alapuolella, kuvailtaisiin 1s22s1: ksi. Elektroni kokoonpanoissa kymmenen ensimmäisen elementit on esitetty alla (huomaa, että valence elektronit ovat elektroni korkein energia kuori, ei vain elektronit eniten energiaa subshell).,

Octet-Sääntö
– Meidän keskustelua valence electron kokoonpanoissa johtaa meidät yksi tärkeimpiä oppeja, kemiallisten liimaus, oktetti sääntö. Octet-säännössä määrätään, että atomien becomeespecially vakaa, kun niiden valence kuoret saada täysi valence elektroneja. Esimerkiksi edellä, Helium (He) ja Neon (Ne) on ulompi valence kuoret, jotka ovat täysin täynnä, joten kumpikaan on taipumus saada tai menettää elektroneja., Siksi Helium ja Neon, kaksi niin kutsuttua jalokaasua, ovat vapaassa atomimuodossa eivätkä yleensä muodosta kemiallisia sidoksia muihin atomeihin.
useimmilla alkuaineilla ei kuitenkaan ole täyttä ulkokuorta ja ne ovat liian epävakaita ollakseen vapaita atomeja. Sen sijaan ne pyrkivät täyttämään ulkoelektronikuorensa muodostamalla kemiallisia sidoksia muiden atomien kanssa ja siten saavuttamaan Jalokaasukonfiguraation. Elementti on taipumus ottaa lyhin polku saavuttaa Jalo Kaasu kokoonpano, onko se tarkoittaa, saada tai menettää elektroni., Esimerkiksi natrium (Na), jolla on yksi elektroni ulommalla 3S-orbitaalillaan, voi menettää kyseisen elektronin saavuttaakseen neonin elektronikonfiguraation. Kloori, jossa on seitsemän valenssielektronia, voi saada yhden elektronin saavuttaakseen argonin konfiguraation. Kun kaksi eri elementeillä on sama elektronikonfiguraatio, niitä kutsutaan isoelectronic.
Diamagnetismille ja Paramagnetism
elektroni kokoonpano atom on myös seurauksia sen käyttäytymistä suhteessa magneettikenttiä. Tällainen käyttäytyminen riippuu siitä, kuinka monta elektronia atomilla on, jotka ovat spin-pareina., Muista, että Koira on Sääntö ja Paulin kieltosääntö yhdistää sanella, että atomin orbitaalit ovat kaikki puoli-täyttää ennen kuin alkaa kokonaan täyttää, ja että kun he täysin täytä kaksi elektronia, nuo kaksi elektronia on päinvastainen pyörii.
atomi, jossa kaikki sen orbitaalit täynnä, ja siksi kaikki sen elektronit pariksi elektronin vastakkaiselle spin, on hyvin vähän vaikuttaa magneettikenttiin. Tällaisia atomeja kutsutaan diagmetisiksi. Päinvastoin, paramagneettinen atomit eivät ole kaikkien niiden elektronien spin-pariksi ja vaikuttavat magneettikenttiä., Paramagneettisuudessa on asteita, sillä atomissa voi olla yksi pariton elektroni tai siinä voi olla neljä.