Miten puskuri toimii?
puskuri pystyy vastustamaan pH-muutosta, koska kaksi komponenttia (konjugaatti happo ja konjugaatti base) ovat molemmat läsnä merkittäviä määriä tasapainotilassa ja pystyvät neutraloimaan pieniä määriä muita happoja ja emäksiä (muodossa H3O+ ja OH -), kun lisätään ratkaisu. Tämän vaikutuksen selventämiseksi voidaan ottaa huomioon yksinkertainen esimerkki Fluorivetyhaposta (HF) ja Natriumfluoridista (NaF)., Fluorivetyhappo on heikko happo, koska vahva vetovoima välillä suhteellisen pieni F – ion ja solvated protonit (H3O+), joka ei ole mahdollista erottaa täysin veteen. Siksi, jos haluamme saada HF vesiliuoksessa, me perustaa seuraavat tasapainon kanssa vain lievä dissosiaatio (Ka(HF) = 6.6×10-4, voimakkaasti suosii reagenssit):
\
Me voidaan sitten lisätä ja liuota natriumfluoridi liuokseen ja sekoita kaksi kunnes pääsemme haluttuun tilavuuteen, ja pH, jossa haluamme puskuri., Kun Natrium-Fluoridi liukenee veteen, reaktio menee loppuun, jolloin saadaan:
\
Koska Na+ on konjugaatti vahva pohja, sillä ei ole vaikutusta pH: n tai reaktiivisuus puskuri. Lisäksi \(NaF\) ratkaisu on kuitenkin lisätä pitoisuus F – puskuriin ratkaisu, ja, näin ollen, Le Chatelier n Periaate, johtaa hieman vähemmän dissosiaatio HF aiemman tasapainon, sekä. Läsnäolo merkittäviä määriä sekä konjugaatti happo, \(HF\) ja konjugaattia pohja -, F-, avulla ratkaisu toimisi puskurina., Puskuriliuoksen titrauskäyrässä näkyy tämä puskurivaikutus.
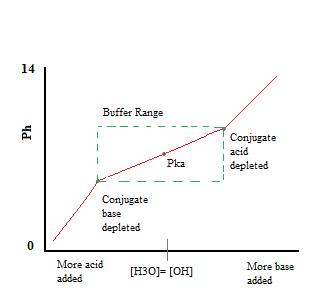
Kuten näemme, yli mittausalueen puskurin. pH muuttuu hyvin vähän lisäämällä happoa tai emästä. Kun puskurointikyky ylittyy, pH: n muutosvauhti hyppää nopeasti. Tämä johtuu siitä, että konjugaattihappo tai emäs on ehtynyt neutraloinnin kautta. Tämä periaate tarkoittaa, että suuremmalla määrällä konjugaattihappoa tai emästä on suurempi puskurointikyky.,
Jos happoa lisättiin:
\
tässä reaktio, konjugaatti pohja -, F-, neutraloi lisätyn hapon, H3O+, ja tämä reaktio menee loppuun, koska reaktio F – kanssa H3O+ on tasapainon jatkuva paljon enemmän kuin yksi. (Itse asiassa, tasapaino, jatkuva reaktio kuin kirjoitettu on vain käänteinen Ka HF: 1/Ka(HF) = 1/(6.6×10-4) = 1.5×10+3.,) Niin kauan kuin on enemmän F – kuin H3O+, lähes kaikki H3O+ kulutetaan ja tasapaino siirtyy oikealle, hieman pitoisuuden lisääminen HF ja hieman vähentää pitoisuus F-, mutta mikä tuskin mitään muuttaa määrä H3O+ läsnä kun tasapaino on palautettu.,
Jos pohja lisättiin:
\
tässä reaktio, konjugaatti happo -, HF -, neutraloi lisätty määriä pohja -, OH-, ja tasapaino on taas siirtyä oikealle, hieman pitoisuuden lisääminen F – liuoksessa ja vähentää määrä HF hieman. Jälleen, koska suurin osa OH-on neutraloitu, pieni pH muutos tapahtuu.
nämä kaksi reaktiota voivat edelleen vaihdella edestakaisin pienellä pH: n muutoksella.