happo-emäs – (proton transfer) reaktio
ensimmäinen esimerkki kemiallinen reaktiivisuus, katsotaanpa hyvin yksinkertainen reaktio, joka tapahtuu välillä hydroksidi-ioni ja suolahappo:
HCl+OH^- \oikea nuoli: H_20+Cl^-
Tämä on happo-emäs reaktio: protoni siirtyy HCl -, happo -, hydroksidi -, pohja. Tuote on vesi (hydroksidin konjugaattihappo) ja kloridi-ioni (HCl: n konjugaattiemäs)., Olet epäilemättä nähnyt tämän reaktion ennenkin yleisessä kemiassa. Huolimatta sen yksinkertaisuus (ja huolimatta siitä, että reagenssit ja tuotteet ovat epäorgaanisia pikemminkin kuin orgaaninen), tämä reaktio antaa meille mahdollisuuden harkita ensimmäistä kertaa monet keskeiset ajatukset orgaaninen kemia, että meidän tulee tutkia eri yhteyksissä koko tämän tekstin.
Avain ymmärtää juuri mitään reaktion mekanismi on käsite electron tiheys, ja miten se on kytketty electron-liikkeen (bond-breaking ja bond-forming), joka tapahtuu reaktio., Että hydroksidi-ioni – erityisesti aine, happi-atomi, että hydroksidi-ioni – on korkea electron tiheys, koska negatiivinen varaus ja napaisuus vety-happi-sidoksen. Hydroksidihappi on elektronipitoinen.

vety-atomin HCl, toisaalta, on alhainen electron tiheys: se on electron-huono. Kuten arvata saattaa, jokin elektronirikas vetää puoleensa jotain elektronirikasta., Kuten hydroksidi-ja HCl lähentyä toisiaan, lone-pair-elektronit-electron-rikas hydroksidi happea on houkutelleet electron-huono proton HCl, ja elektronin liike tapahtuu kohti protoni. Kaksi elektronien vety-kloori-sigma bond on vastenmielistä tämä lähestyy hydroksidi electron tiheys, ja näin ollen siirtää vielä kauemmaksi protoni ja kohti klooria ydin., Seurauksena kaikki tämä elektronien liike on, että vety-kloori-side on rikki, koska kaksi elektronia siitä, että bond täysin irrottautua 1s silmäkuopan vety ja tulla yksinäinen pari 3p orbital on kloridi-anioni.
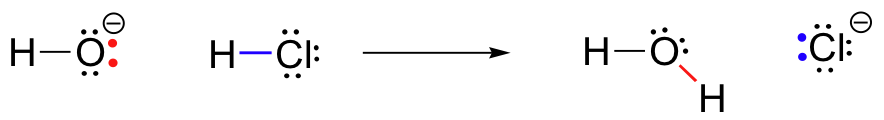
samalla, että vety-kloori-bond on rikkomatta, uusi sigma bond välille muodostuu vetyä ja happea, joka sisältää kaksi elektronia, jotka aiemmin olivat lone-pair on hydroksidi. Tämän sidoksen muodostumisen tulos on tietenkin vesimolekyyli.
aiemmin (kohta 6.1.,), näimme, miten käyriä nuolia käytettiin kuvaamaan elektronien liikettä, joka tapahtuu kemiallisissa reaktioissa, joissa sidokset rikkoutuvat ja syntyy uusia sidoksia. Esimerkiksi HCl + OH-reaktio kuvataan piirtämällä kaksi kaarevaa nuolta.
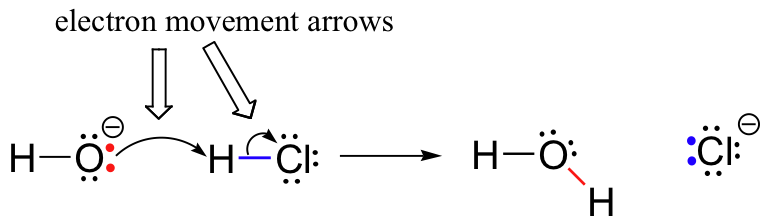
ensimmäinen nuoli on peräisin yksi yksinäinen paria hydroksidi happea ja pistettä ” H ”- symboli vetybromidi molekyyli, joka kuvaa ”hyökkäys” happea yksinäinen pari, ja myöhemmin muodostumista uuden vety-happi-sidoksen., Toinen kaareva nuoli on peräisin, milloin vety-bromia bond ja toteaa, että ’Br’ – symboli, joka osoittaa, että tämä sidos on rikkomatta – kaksi elektronit ovat lähdössä ja tulossa yksinäinen pari bromidi-ioni.
tässä vaiheessa on erittäin tärkeää korostaa, että nämä kaarevat, kaksipiippuiset nuolet edustavat aina kahden elektronin liikettä. Suurin osa tästä kirjasta on omistettu kuvaus reaktiomekanismien, joihin liittyy kahden elektronin liikettä, joten nämä täyspäiset nuolet tulevat hyvin tutuiksi.,

toisella lukukaudella, kuitenkin, me tarkastelemme radikaali reaktio mekanismeja, joissa yhden elektronin liike tapahtuu. Näissä prosesseissa, kaareva, yksi piikkilanka (’kala-koukku’) nuoli käytetään.
Liikunta
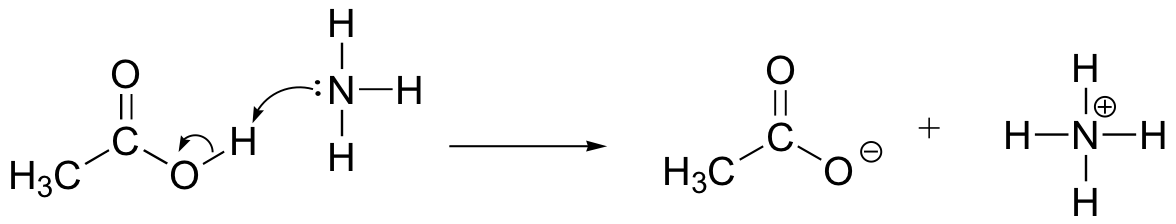
Piirrä electron-liikkeen nuolet kuvaavat happo-emäs reaktion välillä etikkahappo, CH3COOH, ja ammoniakki, NH3. Vedä esiin reaktanttien ja tuotteiden Täydelliset Lewis-rakenteet.