Non tutte le collisioni sono uguali
Per un gas a temperatura ambiente e pressione atmosferica normale, ci sono circa 1033 collisioni in ogni centimetro cubo di spazio ogni secondo. Se ogni collisione tra due molecole reagenti producesse prodotti, tutte le reazioni sarebbero complete in una frazione di secondo. Ad esempio, quando due palle da biliardo si scontrano, rimbalzano semplicemente l’una dall’altra., Questo è il risultato più probabile se la reazione tra A e B richiede una significativa interruzione o riarrangiamento dei legami tra i loro atomi. Per avviare efficacemente una reazione, le collisioni devono essere sufficientemente energetiche (o avere energia cinetica sufficiente) per provocare questa rottura del legame. Questo è ulteriormente discusso di seguito.
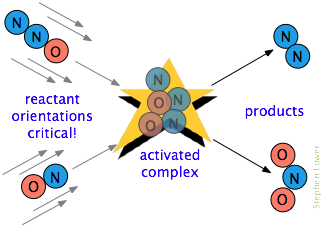
C’è spesso un requisito aggiuntivo. In molte reazioni, specialmente quelle che coinvolgono molecole più complesse, le specie reagenti devono essere orientate in modo appropriato per il particolare processo., Ad esempio, nella reazione in fase gassosa dell’ossido di dinitrogeno con ossido nitrico, l’estremità dell’ossigeno di N2O deve colpire l’estremità dell’azoto di NO; alterare l’orientamento di entrambe le molecole impedisce la reazione. A causa dell’estesa randomizzazione dei moti molecolari in un gas o in un liquido, ci sono sempre abbastanza molecole correttamente orientate affinché alcune delle molecole reagiscano. Tuttavia, più questo requisito orientativo è critico, meno collisioni saranno efficaci.,
Le collisioni energetiche tra molecole fanno sì che i legami interatomici si allunghino e si pieghino, indebolendoli temporaneamente in modo che diventino più suscettibili alla scissione. La distorsione dei legami può esporre le loro nubi di elettroni associate a interazioni con altri reagenti che potrebbero portare alla formazione di nuovi legami.,
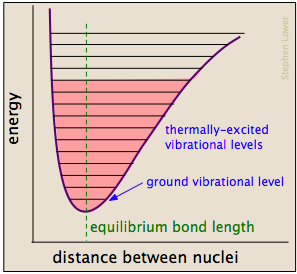
legami Chimici sono alcune delle proprietà di molle meccaniche: il loro potenziale di energie dipende dalla misura in cui essi sono allungati o compressi. Ogni legame atomo-atomo può essere descritto da un diagramma di energia potenziale che mostra come la sua energia cambia con la sua lunghezza., Quando il legame assorbe energia (sia dal riscaldamento o attraverso una collisione), è elevato a uno stato vibrazionale quantizzato superiore (indicato dalle linee orizzontali) che indebolisce il legame mentre la sua lunghezza oscilla tra i limiti estesi corrispondenti alla curva.
Una particolare collisione in genere eccita un certo numero di legami in questo modo. Entro circa 10-13 secondi, questa eccitazione viene distribuita tra gli altri legami nella molecola in modi complessi e imprevedibili che possono concentrare l’energia aggiunta in un punto particolarmente vulnerabile., Il legame interessato può allungarsi e piegarsi più lontano, rendendolo più suscettibile alla scissione. Anche se il legame non si rompe per puro stiramento, può diventare distorto o contorto in modo da esporre le nubi di elettroni vicine a interazioni con altri reagenti che potrebbero incoraggiare una reazione.