L’ossido ferrico, chiamato anche con il suo nome IUPAC iron Trihydrate o iron (III) oxide, è un composto inorganico rappresentato dalla formula chimica Fe2O3 o Fe2H6O3 . È uno degli ossidi di ferro più importanti, gli altri due sono rispettivamente l’ossido ferrosoferrico (Fe3O4) e l’ossido ferroso (FeO). Si presenta naturalmente come l’ematite minerale .,
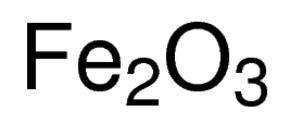
Formula di ossido ferrico
Ossido ferrico idrato
È un composto gelatinoso bruno-rossastro prodotto dopo aggiunta di alcali a soluzioni contenenti sali di Fe(III). È anche chiamato ossido ferrico idroso e può essere rappresentato chimicamente come Fe2O3.H2O o Fe (O)OH . Alcune forme comuni di ossido ferrico idratato includono lepidocrocite rosso che si verifica esternamente in rusticles e goethite arancione che si verifica all’interno di rusticles.,
Come viene preparato l’ossido ferrico
L’ossido ferrico viene sintetizzato in laboratorio attraverso l’elettrolisi della soluzione di bicarbonato di sodio, che agisce come un elettrolita inerte e un anodo di ferro. La conversione elettrolitica del ferro in ossido di ferro idrato (III) è rappresentata come:
4Fe + 3O2 + 2H2O → 4 FeO(OH)
L’ossido di ferro idrato (III), così prodotto, subisce la disidratazione a circa 200 °C per formare ossido ferrico ., di solfato ferroso (FeSO4), che viene ulteriormente ossidato a solfato ferrico :
- FeS2 + 7O+ H2O → FeSO4 + H2SO4
- 2FeSO4 + H2SO4 + O → Fe2(SO4)3 + H2O
Alluminio sostituisce il Ferro Ossido Ferrico
di Alluminio e ossido ferrico subire una reazione redox con il quale il metallo sostituisce il ferro per formare ossido di alluminio:
Fe2O3 + 2Al → Al2O3 + 2Fe
Proprietà e delle Caratteristiche di Ossido Ferrico
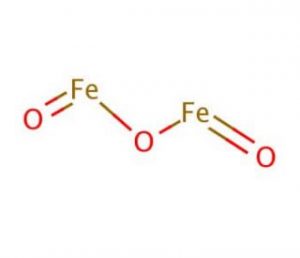
Struttura di Ossido Ferrico
Usa
- In ferro industrie per la produzione di acciaio e leghe .,
- La polvere di ossido ferrico, chiamata anche rouge del gioielliere, viene utilizzata per lucidare lenti e gioielli metallici .
- La sua forma granulare viene utilizzata come mezzo di filtrazione per estrarre i fosfati negli acquari di acqua salata .
- Come approvato dalla FDA pigmento marrone 6 e pigmento rosso 101, per l’uso in cosmetici .
- In applicazioni biomediche, perché le sue nanoparticelle sono atossiche e biocompatibili .
È pericoloso
L’esposizione prolungata ai suoi fumi o polvere può causare pneumoconiosi con febbre, brividi, dolori, mancanza di respiro e tosse ., Il contatto ripetuto con gli occhi può scolorirlo e causare una colorazione permanente del ferro .
- Ferro(III) ossido Chemspider.com
- Ferro Ossido Rosso – Pubchem.ncbi.nlm.hih.gov
- Magnetite (Fe3O4) – Pubchem.ncbi.nlm.nih.gov
- ossido di ferro – Pubchem.ncbi.nlm.nih.gov
- CHEBI:50819 – ossido ferrico – Ebi.ac.uk
- Ossido di Ferro di Fumi e Polveri (come Fe) – Cdc.gov
- Cinetica e meccanismo di disidratazione della γ-FeOOH – Researchgate.net
- Ferro(III) Ossido di Particelle – Americanelements.com
- Ossido Ferrico – Chemicalbook.,com
- Proprietà Magnetiche dei Materiali – Sigmaaldrich.com
- Ferro(III) Ossido Chem.libretexts.org
- Ossido di Ferro (Fe2O3), Idrato (Composto) – Pubchem.ncbi.nlm.nih.gov
- L’ossidazione di solfato ferroso a ferrico solfato per mezzo di aria Archive.org
- Usa di Ossido di Ferro – Zjunited.com
- Sostanze Pericolose scheda di Ossido di Ferro Nj.gov