acido-base (trasferimento di protoni) di reazione
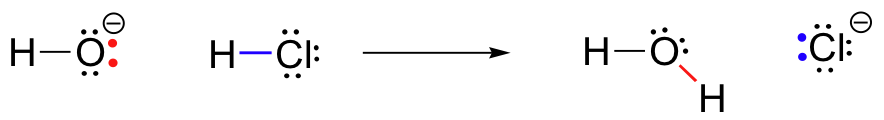
Per il nostro primo esempio di reattività chimica, vediamo un esempio molto semplice reazione che avviene tra l’idrossido di litio e acido cloridrico:
HCl+OH^- \Rightarrow H_20+Cl^-
Questa è una reazione acido-base: un protone è trasferito da HCl, acido, di idrossido di base. Il prodotto è acqua (l’acido coniugato di idrossido) e chloride cloruro (la base coniugata di HCl)., Hai indubbiamente visto questa reazione prima nella chimica generale. Nonostante la sua semplicità (e nonostante il fatto che i reagenti e i prodotti siano inorganici piuttosto che organici), questa reazione ci consente di considerare per la prima volta molte delle idee fondamentali della chimica organica che esploreremo in vari contesti in questo testo.
La chiave per comprendere qualsiasi meccanismo di reazione è il concetto di densità elettronica e come è collegato al movimento degli elettroni (rottura del legame e formazione del legame) che si verifica in una reazione., Lo hydroxide idrossido-in particolare, l’atomo di ossigeno elettronegativo nello hydroxide idrossido-ha un’alta densità elettronica dovuta alla carica negativa e alla polarità del legame idrogeno-ossigeno. L’ossigeno idrossido è ricco di elettroni.

L’atomo di idrogeno in HCl, d’altra parte, ha una bassa densità elettronica: è povero di elettroni. Come ci si potrebbe aspettare, qualcosa che è ricco di elettroni è attratto da qualcosa che è povero di elettroni., Mentre l’idrossido e l’HCl si avvicinano l’uno all’altro, una coppia solitaria di elettroni sull’ossigeno idrossido ricco di elettroni viene attratta dal protone povero di elettroni dell’HCl e il movimento degli elettroni avviene verso il protone. I due elettroni nel legame sigma idrogeno-cloro sono respinti da questa densità elettronica di idrossido che si avvicina, e quindi si allontanano ancora più lontano dal protone e verso il nucleo di cloro., La conseguenza di tutto questo movimento degli elettroni è che il legame idrogeno-cloro è rotto, poiché i due elettroni di quel legame si liberano completamente dall’orbitale 1s dell’idrogeno e diventano una coppia solitaria nell’orbitale 3p di un anione cloruro.
Nello stesso momento in cui il legame idrogeno-cloro si sta rompendo, si forma un nuovo legame sigma tra idrogeno e ossigeno, contenente i due elettroni che in precedenza erano una coppia solitaria sull’idrossido. Il risultato di questa formazione di legami è, ovviamente, una molecola d’acqua.
Precedentemente (sezione 6.1.,), abbiamo visto come le frecce curve sono state usate per rappresentare il movimento degli elettroni che si verifica nelle reazioni chimiche, dove i legami sono rotti e si formano nuovi legami. La reazione HCl + OH, ad esempio, viene rappresentata disegnando due frecce curve.
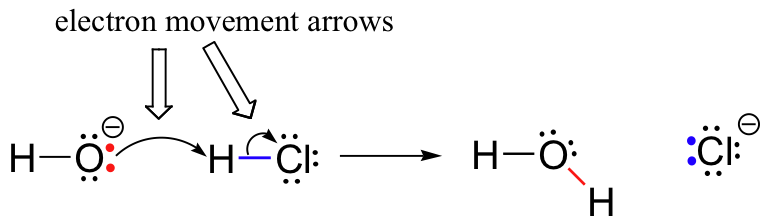
La prima freccia ha origine in una delle coppie solitarie sull’ossigeno idrossido e punta al simbolo ” H “nella molecola di bromuro di idrogeno, illustrando l ‘ “attacco” della coppia solitaria di ossigeno e la successiva formazione del nuovo legame idrogeno-ossigeno., La seconda freccia curva ha origine dal legame idrogeno-bromo e punta al simbolo ‘Br‘, indicando che questo legame si sta rompendo – i due elettroni stanno’ lasciando’ e diventando una coppia solitaria sullo brom bromuro.
È molto importante sottolineare a questo punto che queste frecce curve a due punte rappresentano sempre il movimento di due elettroni. La maggior parte di questo libro sarà dedicata alla descrizione dei meccanismi di reazione che coinvolgono il movimento a due elettroni, quindi queste frecce a testa piena diventeranno molto familiari.,

Nel secondo semestre, tuttavia, esamineremo i meccanismi di reazione radicale, in cui si verifica il movimento a singolo elettrone. Per questi processi, verrà utilizzata una freccia curva a punta singola (“amo da pesca”).
Esercizio
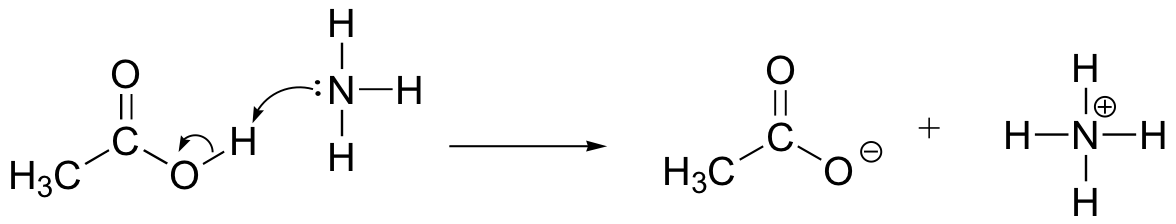
Disegnare frecce di movimento degli elettroni per illustrare la reazione acido-base tra acido acetico, CH3COOH e ammoniaca, NH3. Disegna le strutture Lewis complete di reagenti e prodotti.