Introduzione
Le cellule stromali di derivazione adiposa (ASCs) sono multipotenti e immunoprivilegate, rendendole candidate ideali per scopi terapeutici (Bourin et al., 2013; Ma et al., 2014; Kallmeyer e pepe, 2015). Le ASCs possono essere isolate usando tecniche minimamente invasive da vari depositi di tessuto adiposo nel corpo (Zuk et al., 2001)., Sono caratterizzati dalla loro capacità di aderire alla plastica, da un profilo marcatore superficiale unico e dalla capacità di differenziarsi in osso, grasso e cartilagine (Dominici et al., 2006; Bourin et al., 2013). ASCS comprendono ~15-30% della frazione vascolare stromale (SVF) del tessuto adiposo (Bourin et al., 2013; Zuk, 2013), e devono essere espansi ex vivo al fine di ottenere numeri di cellule sufficienti per scopi terapeutici.,
Fornire prodotti per la terapia cellulare sicuri e regolamentati ai pazienti richiede l’aderenza alle buone pratiche di produzione (GMP) e le linee guida GMP devono essere rispettate durante tutto il processo di isolamento, espansione e differenziazione delle ASCs (Giancola et al., 2012). I numerosi reagenti utilizzati per isolare ed espandere ASCs per scopi di ricerca sono di origine animale o non sono di grado clinico; pertanto, questi devono essere sostituiti con alternative più adatte secondo gli standard GMP (Halme e Kessler, 2006; Riis et al., 2015)., Esaminiamo la scelta della supplementazione di siero che può essere utilizzata per l’espansione ASC al posto del siero bovino fetale (FBS) e descriviamo i loro effetti in vitro e in vivo come riportato in letteratura.,
Società Internazionale di Terapia Cellulare (ISCT) e Internazionale Grasso Tecnologia Applicata Società (IFATS) le Linee guida e le Tecniche Utilizzate per Valutare Derivate da Adiposo Cellule Stromali Caratteristiche
Una serie di criteri minimi e linee guida sono stati raccomandati dalla Società Internazionale di Terapia Cellulare (ISCT) e Internazionale Grasso Tecnologia Applicata Società (IFATS) per la caratterizzazione di ASCs (Dominici et al., 2006; Bourin et al., 2013)., Questi criteri includono la capacità degli ASCs di aderire alla plastica, il loro profilo di marcatore superficiale e il loro potenziale di differenziazione trilineage. L’ultimo documento di posizione descrive la vitalità e la proliferazione come misure aggiuntive ai criteri di caratterizzazione originali. Inoltre, sono stati definiti metodi sperimentali e saggi per misurare i criteri di caratterizzazione (Bourin et al., 2013)., Questi criteri hanno dimostrato di essere influenzati da numerosi fattori come la tecnica di liposuzione, la tecnica di isolamento SVF e il supporto e l’integrazione utilizzati durante il processo di espansione (Koellensperger et al., 2014; Bajek et al., 2015; Busser et al., 2015). Secondo le linee guida IFt e IFATS, è raccomandata e accettata la pratica di ricerca per confermare l’aderenza alle linee guida di cui sopra per ogni condizione di isolamento e coltura al fine di classificare la popolazione cellulare risultante come ASCs.,
Tecniche e metodi utilizzati per caratterizzare gli ASC
Morfologia e aderenza
Una volta seminati, gli ASC aderenti mostrano una morfologia distinta, che può essere descritta come sottile, allungata e a forma di fuso. La valutazione morfologica dell’ASCs è di solito preformata utilizzando la microscopia ottica (Trojahn Kølle et al., 2013).
Proliferazione
Le linee guida IFt e IFATS hanno raccomandato che la proliferazione e la frequenza del progenitore ACSs siano misurate mediante un test di unità di formazione di colonie fibroblastoidi (Bourin et al., 2013)., Altre tecniche utilizzate negli studi citati in questa recensione fanno uso del conteggio delle cellule vitali o della misurazione della capacità proliferativa delle ASC usando l’immunoistochimica. I metodi di conteggio includono (1) il conteggio delle cellule utilizzando un colorante di vitalità e un emocitometro, (2) il conteggio delle cellule utilizzando perline o tecniche di colorazione e analisi citometrica a flusso e (3) utilizzando saggi colorimetrici che misurano le cellule vitali in uno spettrofotometro (Gharibi e Hughes, 2012; Trojahn Kølle et al., 2013; Bogdanova et al., 2014; Atashi et al., 2015; Johal et al., 2015; Oikonomopoulos et al., 2015).,
Immunofenotipo
Le linee guida IFt e IFATS hanno elencato l’espressione di più marcatori di superficie e le loro percentuali attese come requisito fermo nella loro dichiarazione di posizione. Hanno anche raccomandato che l’espressione del marcatore di superficie debba essere misurata mediante colorazione anticorpale multicolore (Bourin et al., 2013). Gli studi in questa recensione hanno fatto uso dell’analisi citometrica a flusso per misurare l’espressione del marcatore di superficie (Müller et al., 2006; Lindroos et al., 2009; Chieregato et al., 2011; Josh et al., 2012; Trojahn Kølle et al., 2013; Bogdanova et al., 2014; Patrikoski et al., 2014).,
Trilineage Differenziazione
la Differenziazione in adiposo, l’osso e la cartilagine è tradizionalmente stata misurata mediante colorazione istochimica tecniche visualizzati di sotto di microscopia; tuttavia, il ISCT e IFATS linee guida hanno consigliato di valutazioni qualitative devono essere sostituiti o integrati con approcci quantitativi, quali la misurazione del lineage-specifici di espressione di mRNA mediante trascrizione inversa quantitativa reazione a catena della polimerasi (RT-qPCR) tecniche (Bourin et al., 2013)., Le tecniche che sono state utilizzate per misurare la capacità di differenziazione, descritte negli studi citati in questa recensione, hanno variato dalla colorazione istochimica, alla PCR convenzionale e RT-qPCR. Le tecniche di colorazione istochimica includono la colorazione delle cellule con (1) olio rosso O e rosso nilo per l’adipogenesi; (2) Alizarina rossa S, fosfatasi alcalina e von Kossa per l’osteogenesi; o (3) Alcian blu e safranina per la condrogenesi (Müller et al., 2006; Kocaoemer et al., 2007; Hebert et al., 2010; Rajala et al., 2010; Koellensperger et al., 2014; Oikonomopoulos et al., 2015; Riis et al., 2016).,
Siero Supplementazione
Siero bovino fetale
FBS è il supplemento siero tradizionale utilizzato per la coltura cellulare. FBS contiene fattori di crescita (GFS) e altri elementi essenziali per l’attaccamento ASC, l’espansione, il mantenimento e la proliferazione in vitro (Lennon et al., 1995, 1996; Zuk et al., 2001; van der Valk et al., 2010). FBS è soggetto a variazione batch-to-batch, xenoimmunizzazione e possibile contaminazione con micoplasma, virus, endotossine e prioni (van der Valk et al., 2004, 2010; Chieregato et al., 2011; Kyllonen et al., 2013; Jin et al., 2015)., La fonte e la qualità di FBS possono influenzare la proliferazione e la differenziazione di ASCs, e lo screening di routine per micoplasma, endotossine e virus è diventato importante (Naaijkens et al., 2012). Questi fattori possono influenzare i risultati sperimentali e rendere il prodotto cellulare pericoloso per l’uso clinico (Zuk et al., 2001; van der Valk et al., 2004; Witzeneder et al., 2013).
Le ASCS sono immunoprivilegiate, prive dell’espressione del complesso di istocompatibilità principale di classe II e delle molecole costimulatorie delle cellule T e B (CD80, CD86 e CD40)., L’immunogenicità in vitro e le proprietà immunosoppressive di ASCs sono misurate solitamente co-coltivando l’ASCs con le cellule mononucleate del sangue periferico nelle reazioni miste dei linfociti e misurando la risposta proliferativa delle cellule T (McIntosh et al., 2006; Patrikoski et al., 2014). Le ASCS dimostrano proprietà immunomodulatorie e immunosoppressive, come dimostrato dalla loro capacità di regolare la funzione delle cellule T e modulare la secrezione di citochine in vitro e in vivo (Leto Barone et al., 2013; Roemeling-van Rhijn et al., 2013; Patrikoski et al., 2014)., Queste proprietà derivano dalla bassa immunogenicità delle ASCs. La maggior parte degli studi clinici di ASC e di altre cellule staminali mesenchimali (MSC) (fase I, II e III) utilizza supporti integrati con FBS ed è stato riportato che gli effetti immunogenici sono provocati da componenti di FBS in soggetti umani (Sundin et al., 2007; Riis et al., 2015). Ad esempio, uno studio clinico con MSCS derivato dal midollo osseo (BM-MSCs) espanso in FBS ha trovato anticorpi contro componenti di FBS (Horwitz et al., 2002)., Risposte immunitarie a FBS come Arthus e reazioni anafilattiche sono state riportate in studi clinici, in cui i pazienti sono stati trattati con cellule dendritiche e linfociti esposti a FBS (Selvaggi et al., 1997; Mackensen et al., 2000). Al contrario, una meta-analisi degli studi clinici MSC ha rilevato che oltre il 75% degli esperimenti ha utilizzato FBS nei loro protocolli di espansione cellulare e solo uno studio ha monitorato e dimostrato reazioni avverse a FBS (Lalu et al., 2012)., Gli studi in vivo che esaminano la risposta immunitaria dei topi all’ASCs hanno mostrato immunosoppressione e immunomodulazione conservate, bassa immunogenicità e nessuna reazione all’FBS (Cho et al., 2009; González et al., 2009). Sebbene le ASCs siano ampiamente testate negli studi clinici, il loro uso definitivo come agente terapeutico rimane da stabilire. Ciò è ulteriormente aggravato dall’uso di modelli preclinici che potrebbero non essere biologicamente rilevanti (Monsarrat et al., 2016). Inoltre, FBS può essere meno immunogenico nei topi e in altri modelli animali che negli esseri umani., Infine, la risposta immunitaria suscitata da FBS (Selvaggi et al., 1997; Mackensen et al., 2000; Horwitz et al., 2002) potrebbe in teoria influenzare il rigetto delle cellule trapiantate nella terapia cellulare.
Alternative senza siero
La composizione sconosciuta e indefinita di FBS è un grosso inconveniente. Un’alternativa preferibile sarebbe un mezzo chimicamente definito con una composizione nota come mezzi disponibili in commercio senza siero (SF) o XF (Usta et al., 2014)., Si presume erroneamente che questi mezzi privi di siero siano privi di prodotti animali poiché i termini SF e XF sono spesso usati in modo intercambiabile. Tuttavia, i supporti SF sono solitamente integrati con albumina sierica di origine animale o umana e GFS in quantità indefinite (Patrikoski et al., 2013). I mezzi xeno-liberi, d’altra parte, sono mezzi chimicamente definiti contenenti componenti ben definiti a concentrazioni specifiche (Usta et al., 2014).
Fattori di crescita
Un’altra alternativa al siero è l’aggiunta di GFs al terreno di coltura, sia in isolamento, sia come cocktail., Questi GFS possono essere sintetici, derivati dagli animali o derivati dall’uomo. La sostituzione con GFS sintetici è preferibile a causa della loro maggiore qualità e come risultato della standardizzazione tra lotti, che potrebbe non essere possibile per GFS di origine animale o umana. I GFS comunemente usati sono il fattore di crescita dei fibroblasti, il fattore di crescita epidermico e il fattore di crescita derivato dalle piastrine (PDGF; Baer e Geiger, 2012; Ahearne et al., 2014). L’aggiunta di GFs è stata collegata ad un aumento della proliferazione (Hebert et al., 2010; Gharibi e Hughes, 2012)., Un potenziale di differenziazione adipogenico migliorato è stato precedentemente riportato in ASCS ampliato in mezzo integrato GF (Hebert et al., 2010). Tuttavia, un altro studio ha osservato un effetto negativo sulla differenziazione adipogenica e osteogenica nelle ASCs coltivate a lungo termine (Gharibi e Hughes, 2012).
Albumina sierica
L’albumina sierica è una proteina plasmatica abbondante e può essere isolata dall’uomo e dagli animali. Spesso i supporti SF sono integrati con albumina sierica., Studi che confrontano l’albumina sierica umana per la supplementazione di mezzi ASC hanno trovato una migliore proliferazione, una morfologia simile a un fuso più piccola e una differenziazione preservata in adiposo, osso e cartilagine (Rajala et al., 2010; Johal et al., 2015).
Il mezzo XF chimicamente definito
è stato raccomandato come sostituto di FBS e siero, in quanto contiene i componenti necessari per l’espansione ASC, non comporta variazioni da donatore a lotto, è conforme a GMP e ha immunogenicità minima e immunosoppressione favorevole (van der Valk et al., 2004, 2010; Usta et al.,, 2014). Rispetto all’FBS, l’uso del mezzo XF per l’espansione dell’ASCs ha portato a una migliore qualità morfologica, una maggiore proliferazione, un immunofenotipo comparabile e differenziazione in adiposo, osso e cartilagine (Lindroos et al., 2009; Patrikoski et al., 2013; Oikonomopoulos et al., 2015). L’uso di supporti XF nell’espansione ASC provoca la perdita della capacità di aderire alla plastica (Kyllonen et al., 2013; Patrikoski et al., 2013; Oikonomopoulos et al., 2015). Sono necessari ulteriori agenti di rivestimento per mantenere la caratteristica intrinseca dell’aderenza della plastica associata all’ASCs., Il mezzo XF disponibile in commercio è costoso e la preparazione del mezzo XF interno può richiedere molto tempo e può aumentare il rischio di variazioni da lotto a lotto (Lund et al., 2009; Baer et al., 2010; Rajala et al., 2010; Yang et al., 2012; Kyllonen et al., 2013; Patrikoski et al., 2013; Oikonomopoulos et al., 2015).
Alternative umane
Le alternative umane possono sostituire i supporti integrati FBS e SF / XF e possono creare un ambiente culturale che assomigli più accuratamente all’ambiente umano (Azouna et al., 2012; Koellensperger et al., 2014)., Inoltre, l’uso di prodotti autologi (derivati dallo stesso individuo) evita la necessità di test per agenti infettivi e altri agenti patogeni.
Siero umano
Dopo che il sangue intero è stato permesso di coagulare in assenza di un anticoagulante ed è stato centrifugato, il siero è la porzione liquida risultante che non contiene piastrine, globuli bianchi o globuli rossi (Figura 1; Stedman, 2006). Il siero umano (HS) può essere autologo (donatore e ricevente sono lo stesso individuo) o allogenico (derivato da individui che sono diversi dal ricevente)., Sia l’HS autologo che allogenico sono superiori a FBS (Stute et al., 2004; Bieback et al., 2009, 2012; Bernardo et al., 2011; Kyllonen et al., 2013; Patrikoski et al., 2013). Le ASC espanse in HS hanno una maggiore stabilità del trascrittoma rispetto a quelle espanse in FBS, mentre i geni responsabili del prolungamento del ciclo cellulare, della differenziazione e della matrice extracellulare e della sintesi delle prostaglandine sono sovraregolati e sovraespressi in FBS rispetto a HS utilizzando l’analisi microarray (Shahdadfar et al., 2005)., ASCS ampliato in FBS raggiunto senescenza prima e visualizzato telomero accorciamento rispetto ad ASCS ampliato in HS (Shahdadfar et al., 2005). La scelta di HS sembra avere scarso effetto sulle proprietà immunomodulatorie di ASCs. ASCS espansa in entrambi i mezzi contenenti HS allogenico o FBS aveva bassa immunogenicità e portato a immunosoppressione (Patrikoski et al., 2014). ASCs ampliato in entrambi autologo o allogenico HS visualizzare una maggiore proliferazione e un immunofenotipo indistinguibile rispetto ad ASCs espansa in FBS (Josh et al., 2012; Bogdanova et al., 2014)., Le ASCS espanse in HS allogenico sono state differenziate in adiposo, osso e cartilagine, sebbene la sovraregolazione dei geni condrogenici e osteogenici sia stata favorita rispetto a FBS (Josh et al., 2012). Le ASCs espanse in HS autologo sono state differenziate in adiposo e cartilagine; tuttavia, la capacità di differenziarsi in osso era meno favorita (Bogdanova et al., 2014). L’HS autologo può fornire all’ASCs una migliore proliferazione e stabilità genomica come determinato dall’analisi microarray rispetto all’HS allogenico (Shahdadfar et al., 2005; Bieback et al., 2009; Bernardo et al., 2011)., ASCS ampliato in HS allogenico entrato arresto della crescita e ha subito la morte cellulare (Shahdadfar et al., 2005; Lindroos et al., 2009), che limita i potenziali vantaggi dell’HS allogenico. Mentre l’HS autologo potrebbe essere l’ideale, la sua disponibilità è limitata e ci possono essere variazioni significative tra i pazienti nella capacità del proprio siero di supportare la crescita delle proprie cellule (Lange et al., 2007). In alternativa, l’HS allogenico può essere messo in comune, producendo maggiori quantità per la sperimentazione di laboratorio e può essere sottoposto a rigorosi test di qualità da una banca del sangue (ad es.,, test per l’assenza di agenti infettivi e contaminazione con altre cellule del sangue) prima dell’uso negli esseri umani (Bieback et al., 2009).
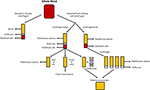
Figura 1. Produzione delle diverse alternative umane. Il siero viene prodotto quando il sangue intero viene lasciato coagulare e centrifugato per pellet globuli rossi e bianchi e piastrine. Il plasma è prodotto dalla prevenzione della coagulazione seguita dalla centrifugazione., A seconda della velocità di centrifugazione, viene prodotto plasma povero di piastrine (PPP; centrifugazione rapida) o plasma ricco di piastrine (PRP; centrifugazione più lenta). Se il PPP è conservato a -18°C è noto come plasma fresco congelato. I concentrati piastrinici possono essere prodotti prendendo il plasma povero piastrinico e 4 buffy coat e raggruppandoli insieme o centrifugando più PRP e raggruppando i pellet piastrinici (sospesi in una piccola quantità di plasma) insieme.,
Plasma
Il plasma è la porzione liquida non cellulare del sangue che contiene acqua, elettroliti e proteine (fattori di coagulazione, fibrinogeno e anticoagulanti). Il plasma povero di piastrine (PPP), il plasma fresco congelato (FFP) e il plasma ricco di piastrine (PRP; Figura 1) possono essere ottenuti da sangue intero mediante centrifugazione a velocità diverse e successiva conservazione a temperature diverse. La secrezione di GF può essere migliorata attivando le piastrine nel sangue intero con trombina prima della centrifugazione (Doucet et al., 2005; Kocaoemer et al.,, 2007), migliorando così l’attività dei prodotti al plasma.
Il plasma povero di piastrine
Il PPP è quasi privo di piastrine ed è prodotto da sangue intero mediante l’aggiunta di un anticoagulante durante il processo di raccolta, dopo di che il plasma viene separato mediante centrifugazione rapida (Figura 1; Koellensperger et al., 2006). Ciò consente di pellettare le piastrine e i globuli rossi. Il PPP risultante viene conservato a 4°C e viene indicato come plasma fresco., Il PDGF è secreto dalle piastrine aggreganti; tuttavia, il PDGF trascurabile viene rilasciato in PPP a causa del piccolo numero di piastrine residue. GFS può quindi avere bisogno di essere aggiunto a PPP quando viene utilizzato in media come è il caso quando si utilizza il mezzo SF (Müller et al., 2006; Gottipamula et al., 2013). Utilizzando PPP senza l’aggiunta di GFS ha portato a tassi di proliferazione più bassi e un minore aumento della sintesi del DNA come misurato utilizzando l’incorporazione di timidina, se confrontato con HS e FBS (Vogel et al., 1980; Koellensperger et al., 2006)., Il PPP con GFS aggiunto ha determinato un aumento dei tassi di proliferazione rispetto all’HS (Koellensperger et al., 2006); tuttavia, queste differenze potrebbero essere sorte da diversi protocolli di produzione di PPP e dall’aggiunta di diversi livelli di GFS a ciascuna delle preparazioni di PPP in questo studio. L’espansione di ASCs nei risultati di PPP nella proliferazione migliore una volta confrontata a FBS ed ha differenziazione osteogenica che è comparabile a quella di ASCs espansa in HS (Koellensperger et al., 2014)., La differenziazione condrogenica è diminuita in ASCS espansa in PPP rispetto a ASCs espansa in PRP (Koellensperger et al., 2014).
Il plasma fresco congelato
FFP si ottiene allo stesso modo del PPP, ma viene congelato direttamente dopo la separazione a -18°C (O’Shaughnessy et al., 2004; Liumbruno et al., 2009). FFP è stato utilizzato nell’espansione di BM-MSCs con risultati positivi., Questi risultati includono una migliore proliferazione, attività immunosoppressiva e differenziazione in adipociti e osteociti; e un immunofenotipo e morfologia che è paragonabile alle cellule espanse in FBS (Müller et al., 2006; Mannello e Tonti, 2007). Tuttavia, l’uso di FFP come sostituto del siero nell’espansione ASC richiede ulteriori indagini.
Plasma ricco di piastrine
La PRP è la porzione di sangue arricchita nelle piastrine. Il PRP viene prodotto separando il plasma dai globuli rossi a velocità di centrifugazione più lente, il che impedisce la pellettatura delle piastrine (Figura 1)., ASCS ampliato in PRP mantenere un immunofenotipo classico e morfologia, e PRP aumenta la proliferazione rispetto a FBS (Kocaoemer et al., 2007; Chieregato et al., 2011; Atashi et al., 2015). Le ASC espanse in PRP hanno migliorato l’efficienza di differenziazione verso i lignaggi adipogenici e osteogenici, pur avendo un’efficienza comparabile per la differenziazione condrogenica, rispetto alle ASC espanse in FBS (Kocaoemer et al., 2007; Chieregato et al., 2011). Se confrontato, HS è risultato essere leggermente migliore di PRP in termini di differenziazione e proliferazione di ASCs (Kocaoemer et al.,, 2007; Chieregato et al., 2011). PRP è un integratore di terreno di coltura mal definito a causa della sua elevata variabilità biologica e della complicata procedura di estrazione, in cui la purificazione del surnatante ricco di fattore piastrinico dalle membrane plasmatiche può essere difficile. L’uso del PRP è limitato dalle grandi quantità di sangue intero necessarie per produrre abbastanza PRP per la sperimentazione (Chieregato et al., 2011).,
Lisato piastrinico
Il lisato piastrinico umano (HPL) contiene GFS piastrinici che si ottengono lisando le piastrine concentrate in un piccolo volume di plasma (concentrati piastrinici; Figura 1) mediante shock termico. HPL contiene una maggiore concentrazione di GFS rispetto ad altri sostituti del siero tra cui PRP umano e FBS (Doucet et al., 2005; Bernardo et al., 2006, 2011; Bieback et al., 2009; Schallmoser et al., 2010)., HPL può essere facilmente ottenuto e prodotto da prodotti di aferesi e buffy coats e può essere risospeso in PRP o in una soluzione additiva (Schallmoser e Strunk, 2013; Iudicone et al., 2014). L’HPL è prodotto congelando le piastrine tra -30 e -80°C per 24 ore, seguita da una fase di scongelamento e centrifugazione. I ripetuti cicli di congelamento, disgelo e centrifuga consentono il rilascio di GFs e la rimozione dei corpi piastrinici (Bernardo et al., 2006; Schallmoser et al., 2007)., Un altro vantaggio della supplementazione di HPL è che le piastrine possono essere utilizzate dopo la data di scadenza di 4-5 giorni del sangue bancato (Bieback et al., 2009). L’HPL è un’alternativa migliore rispetto all’HS autologo e allogenico, poiché le ASCS espanse nell’HPL mantengono il loro classico immunofenotipo, differenziazione, efficienza clonogenica, purezza cellulare e vitalità cellulare (Trojahn Kølle et al., 2013; Riis et al., 2016). HPL inoltre sostiene l’espansione a lungo termine senza compromettere le proprietà immunomodulatorie di ASCs, come misurato dall’analisi citometrica di flusso (Bieback et al., 2009)., L’espansione dell’HPL si traduce in un tempo di raddoppio della popolazione più breve, riducendo il tempo necessario per l’espansione cellulare e riducendo la minaccia di senescenza e trasformazione (Doucet et al., 2005; Shahdadfar et al., 2005; Bernardo et al., 2006, 2011; Azouna et al., 2012). La bio-sicurezza dell’HPL è stata valutata utilizzando l’ibridazione genomica comparativa di array e il cariotipo spettrale ad alta sensibilità, dove è stato riscontrato che le ASCs espanse nell’HPL non avevano aberrazioni cromosomiche (Crespo-diaz et al., 2011; Trojahn Kølle et al., 2013)., La morfologia ASC classica (sottile, più piccola, allungata e a forma di fuso) è mantenuta in HS e HPL, mentre le ASC espanse in FBS sono più grandi e meno a forma di fuso (Trojahn Kølle et al., 2013). Sebbene ciò possa indicare che sia HS che HPL selezionano per ASCS primitivi / immaturi (Doucet et al., 2005; Bieback et al., 2009), suggerisce anche che le cellule coltivate in FBS hanno ridotto la proliferazione e progrediscono più rapidamente verso la senescenza. HPL varia tra gli individui (Bernardo et al., 2006; Crespo-diaz et al., 2011), e la variazione da lotto a lotto viene ridotta quando l’HPL viene raggruppato (Schallmoser et al.,, 2007; Trojahn Kølle et al., 2013). Inoltre, mettendo in comune molti donatori, è possibile ottenere una grande quantità per l’integrazione, il che rende l’HPL preferibile al PRP (Kocaoemer et al., 2007; Bieback et al., 2009; Chieregato et al., 2011).
Conclusione
Secondo Riis et al. di tutti gli studi clinici registrati che utilizzano ASCS espansi che hanno elencato le loro condizioni di espansione, la maggior parte fanno uso di FBS, tre studi utilizzano HS autologo, uno studio utilizza PRP, e uno studio utilizza HPL (Riis et al., 2015)., Queste statistiche sono allarmanti, poiché l’FBS ha il potenziale per trasmettere malattie zoonotiche dopo il trapianto di cellule e sono state riportate reazioni immunitarie contro i componenti dell’FBS (Selvaggi et al., 1997; Mackensen et al., 2000). FBS è un prodotto non conforme alle GMP, poiché influisce sulla sicurezza e sull’efficacia dell’ASC terapeutico e quindi deve essere sostituito (van der Valk et al., 2004; Kyllonen et al., 2013; Witzeneder et al., 2013). Questo è stato risolto sostituendo FBS con alternative derivate umane chimicamente definite., Il passaggio da FBS a alternative umane o media XF/SF in medicina rigenerativa ha l’importante vantaggio che le ASCs proliferano molto più velocemente in quest’ultimo, con conseguente maggior numero di cellule per il trapianto in un tempo più breve. Tuttavia, la relativa superiorità dei diversi media culturali è ancora ampiamente dibattuta. Studi che confrontano più di un mezzo di coltura hanno riportato risultati variabili (Lange et al., 2007; Bernardo et al., 2011; Koellensperger et al., 2014; Riis et al., 2016). Koellensperger et al., rispetto la differenziazione trilineare di ASCs espansa in FBS, PRP, PPP e HS (Koellensperger et al., 2014). I loro risultati hanno rivelato che ogni mezzo di coltura ha permesso la differenziazione in uno o più lignaggi, ma mai in tutti e tre i lignaggi. Quando sono stati confrontati i supporti XF, FBS e HPL integrati, Riis et al. ha scoperto che alcune sottopopolazioni esprimevano marcatori di superficie specifici a seconda del mezzo di coltura utilizzato (Riis et al., 2016)., Gli studi che hanno confrontato l’immunofenotipo di ASCs espanso in FBS e gli altri mezzi di coltura, hanno trovato poca o nessuna differenza nell’espressione del marcatore della superficie cellulare, indipendentemente dai marcatori studiati (Tabella 1). La densità di semina, la tensione dell’ossigeno, la confluenza, la dissociazione e la scelta dei mezzi basali possono anche influenzare i risultati sperimentali (Sotiropoulou et al., 2006; Freshney, 2010; Bourin et al. Inamdar, 2013; Inamdar e Inamdar, 2013; Feng et al., 2014; Riis et al., 2015)., La scelta del terreno di coltura dipende dall’applicazione a valle di queste cellule (somministrazione di ASCS differenziate o non differenziate) e dalla condizione da trattare. Inoltre, l’immunogenicità del mezzo di coltura utilizzato per espandere le cellule prima dell’applicazione clinica deve essere considerata come un parametro che potrebbe influenzare l’esito clinico. La maggior parte degli studi che confrontano diversi mezzi di coltura ha utilizzato i criteri specificati dall’IFt e dall’ifats per convalidare l’uso di un’alternativa all’FBS., La maggior parte di questi studi esamina la morfologia ASC, la proliferazione, l’immunofenotipo e la capacità di queste cellule di differenziarsi lungo lignaggi osteogenici, condrogenici e adipogenici in diversi terreni di coltura. Pochi studi hanno esplorato altri aspetti dell’ASCs, come la senescenza, la stabilità genetica, il trascrittoma, il proteoma, l’immunogenicità, la secrezione di citochine e il ciclo cellulare (Shahdadfar et al., 2005; Bieback et al., 2012). Mentre i criteri IFt e IFATS erano un tentativo di unificare il campo in termini di procedure operative standard (Dominici et al., 2006; Bourin et al.,, 2013), non esiste consenso su quali proprietà di ASCs siano rilevanti per gli studi clinici, rendendo praticamente impossibile il confronto tra diversi mezzi di coltura. Mentre questi criteri forniscono risultati misurabili per un facile confronto, la modifica dei componenti utilizzati per l’espansione di ASCs può avere effetti diversi sulla sicurezza, l’efficacia e la riproducibilità dei prodotti finali ASC. L’esame dei cambiamenti nel trascrittoma, nel proteoma e nel secretoma di ASCs espansi in vari mezzi di coltura è importante, così come l’uso di cellule espanse in condizioni variabili in modelli preclinici appropriati.,

Tabella 1. Gli effetti dei diversi integratori di media su ASCs in vitro.
Contributi dell’autore
CD concettualizzato e redatto la revisione, e approvato il manoscritto finale. MP assistito nella concettualizzazione della revisione, rivisto, e approvato il manoscritto finale. MSP ha assistito nella concettualizzazione della revisione, ha curato e approvato il manoscritto finale e ha raccolto i finanziamenti per i progetti in questione. Tutti gli autori hanno letto e approvato il manoscritto finale.,
Finanziamento
Questa ricerca e la sua pubblicazione sono il risultato di un finanziamento fornito dal Medical Research Council del Sud Africa in termini di (a) Flagships Awards del MRC Progetto SAMRC-RFA-UFSP-01-2013/CELLULE STAMINALI e (b) l’unità extramurale per la ricerca e la terapia sulle cellule staminali. Anche la National Research Foundation del Sud Africa ha fornito finanziamenti.
Dichiarazione sul conflitto di interessi
Gli autori dichiarano che la ricerca è stata condotta in assenza di relazioni commerciali o finanziarie che potrebbero essere interpretate come un potenziale conflitto di interessi.,
Ringraziamenti
Gli autori desiderano ringraziare la dott. ssa Cheryl Tosh per la sua assistenza editoriale.
Chieregato, K., Castegnaro, S., Madeo, D., Astori, G., Pegoraro, M., e Rodeghiero, F. (2011). Fattore di crescita epidermico, fattore di crescita del fibroblasto di base e fattore di crescita derivato dalle piastrine-bb può sostituire il siero bovino fetale e competere con il plasma umano ricco di piastrine nell’espansione ex vivo delle cellule stromali mesenchimali derivate dal tessuto adiposo. Citoterapia 13, 933-943. doi: 10.3109 / 14653249.2011.,583232
PubMed Abstract | CrossRef Full Text/Google Scholar
Mannello, F., and Tonti, G. (2007). Recensione concisa: nessuna innovazione per la coltura di cellule staminali mesenchimali ed embrionali umane: mezzo condizionato, strato di alimentatore o senza alimentatore; mezzo con siero di vitello fetale, siero umano o plasma arricchito; siero-libero, siero sostitutivo mezzo non condizionato o formula ad hoc? tutto ciò che luccica non è oro! Cellule staminali 25, 1603-1609. doi: 10.1634 / stemcells.2007-0127
PubMed Abstract | CrossRef Full Text/Google Scholar
Selvaggi, TA, Walker, R. E.,, e Fleisher, TA (1997). Sviluppo di anticorpi contro siero di vitello fetale con reazioni simili ad arthus in pazienti con infezione da virus dell’immunodeficienza umana trattati con infusioni di linfociti singeneici. Sangue 89, 776-779.
PubMed Abstract/Google Scholar
Stedman, TL (2006). Dizionario medico di Stedman. Filadelfia, PA: Lippincott Williams & Wilkins.
Google Scholar