Come funziona un buffer?
Un tampone è in grado di resistere al cambiamento di pH perché i due componenti (acido coniugato e base coniugata) sono entrambi presenti in quantità apprezzabili all’equilibrio e sono in grado di neutralizzare piccole quantità di altri acidi e basi (sotto forma di H3O+ e OH-) quando vengono aggiunti alla soluzione. Per chiarire questo effetto, possiamo considerare il semplice esempio di un tampone di acido fluoridrico (HF) e fluoruro di sodio (NaF)., L’acido fluoridrico è un acido debole dovuto alla forte attrazione tra lo relatively F relativamente piccolo e i protoni solvatati (H3O+), che non gli consente di dissociarsi completamente in acqua. Pertanto, se vogliamo ottenere HF in una soluzione acquosa, si stabilisce il seguente equilibrio con un solo lieve dissociazione (Ka(HF) = 6.6×10-4, fortemente favori reagenti):
\
Possiamo quindi aggiungere e sciogliere il fluoruro di sodio in soluzione e mescolare i due, fino a raggiungere il volume desiderato e pH al quale vogliamo buffer., Quando il fluoruro di sodio si dissolve in acqua, la reazione va a completamento, quindi otteniamo:
\
Poiché Na+ è il coniugato di una base forte, non avrà alcun effetto sul pH o sulla reattività del tampone. L’aggiunta di \(NaF\) alla soluzione, tuttavia, aumenterà la concentrazione di F – nella soluzione tampone e, di conseguenza, secondo il principio di Le Chatelier, porterà anche a una dissociazione leggermente inferiore dell’HF nell’equilibrio precedente. La presenza di quantità significative sia dell’acido coniugato, \(HF\), sia della base coniugata, F -, consente alla soluzione di funzionare come tampone., Questa azione di buffering può essere vista nella curva di titolazione di una soluzione tampone.
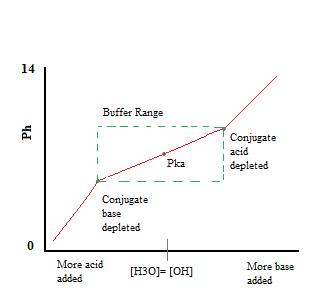
Come possiamo vedere, oltre il campo di lavoro del buffer. Il pH cambia molto poco con l’aggiunta di acido o base. Una volta superata la capacità di buffering, la velocità di variazione del pH salta rapidamente. Ciò si verifica perché l’acido coniugato o la base sono stati esauriti attraverso la neutralizzazione. Questo principio implica che una maggiore quantità di acido coniugato o base avrà una maggiore capacità tampone.,
Se l’acido è stato aggiunto:
\
In questa reazione, la base coniugata, F-, neutralizzerà l’acido aggiunto, H3O+, e questa reazione va a completamento, perché la reazione di F – con H3O+ ha una costante di equilibrio molto maggiore di una. (Infatti, la costante di equilibrio la reazione come scritto è solo l’inverso del Ka per HF: 1/Ka(HF) = 1/(6.6×10-4) = 1.5×10+3.,) Finché c’è più F – di H3O+, quasi tutto l’H3O+ sarà consumato e l’equilibrio si sposterà verso destra, aumentando leggermente la concentrazione di HF e diminuendo leggermente la concentrazione di F-, ma con conseguente quasi nessun cambiamento nella quantità di H3O+ presente una volta ristabilito l’equilibrio.,
Se la base è stata aggiunta:
\
In questa reazione, l’acido coniugato, HF, neutralizzerà le quantità aggiunte di base, OH-, e l’equilibrio si sposterà nuovamente a destra, aumentando leggermente la concentrazione di F – nella soluzione e diminuendo leggermente la quantità di HF. Ancora una volta, poiché la maggior parte dell’OH – viene neutralizzata, si verificherà un piccolo cambiamento di pH.
Queste due reazioni possono continuare ad alternarsi avanti e indietro con pochi cambiamenti di pH.