Rutherford a Manchester, 1907-1919
Ernest Rutherford scoprì il nucleo dell’atomo nel 1911. Lo leggiamo nei libri di testo e negli scritti popolari. Ma cosa significa questa affermazione? Scoperta geografica di solito significa che si vede un luogo per la prima volta. Ma la scoperta può essere la stessa per un regno nascosto alla vista? Non si può vedere un atomo in questo senso., Quindi questo suggerisce che forse la storia della scoperta del nucleo era più complicata. La storia come si è svolta nel laboratorio di Rutherford presso l ” Università di Manchester ruotava intorno a persone reali. Ha coinvolto frustrazioni e trionfi. Si trattava di duro lavoro e perplessità e ispirazione.
 Quando Rutherford divenne professore a Manchester nel 1907, trovò laboratori moderni sia per l’insegnamento che per la ricerca. Su sollecitazione del suo predecessore, Arthur Schuster, oltre £40.000 è stato sollevato per dotare il programma di fisica. Per confronto, il generoso stipendio di Rutherford era di £1.600 / anno., Credito: Dal libro: The physical laboratories of the University of Manchester: a record of 25 years ‘ work by the University of Manchester, Manchester: At the University Press, 1906. AIP Emilio Segrè Archivi Visivi, Collezione Brittle Books.
Quando Rutherford divenne professore a Manchester nel 1907, trovò laboratori moderni sia per l’insegnamento che per la ricerca. Su sollecitazione del suo predecessore, Arthur Schuster, oltre £40.000 è stato sollevato per dotare il programma di fisica. Per confronto, il generoso stipendio di Rutherford era di £1.600 / anno., Credito: Dal libro: The physical laboratories of the University of Manchester: a record of 25 years ‘ work by the University of Manchester, Manchester: At the University Press, 1906. AIP Emilio Segrè Archivi Visivi, Collezione Brittle Books.
Rutherford arrivò a Manchester nell’estate del 1907, mesi prima che iniziasse il mandato dell’università. Era stato nominato Langworthy Professore di Fisica, successore di Arthur Schuster (1851-1934), che si ritirò all’età di 56 anni per reclutare Rutherford. Schuster aveva costruito un edificio di fisica moderna, assunto Hans Geiger, Ph. D., (1882-1945) a causa della sua abilità sperimentale, e dotato di una nuova posizione in fisica matematica per completare un programma completo di fisica. Rutherford entrò nel centro del mondo della fisica. I ricercatori sono venuti da lui a dozzine.
Rutherford è arrivato con molte domande di ricerca in mente. Non aveva finito con gli enigmi delle famiglie di decadimento del torio, del radio, ecc., ma stava passando gran parte di questo lavoro a Boltwood, Hahn, e Soddy. Boltwood e Hahn lavorarono entrambi con Rutherford a Manchester, Boltwood nel 1909-1910 e Hahn nel 1907-1908., Rutherford stava gradualmente rivolgendo la sua attenzione molto di più ai raggi α (alfa), β (beta) e γ (gamma) stessi e a ciò che potrebbero rivelare sull’atomo. Cioè, stava lasciando la radio-chimica agli altri e si rivolgeva alla fisica.
 Rutherford riuniva sempre un gruppo di brillanti giovani ricercatori intorno a lui. In questa foto di gruppo del 1910 sono Ernest Marsden e Hans Geiger. Davanti e al centro sono i professori Schuster e Rutherford, e centrato nella parte posteriore è William Kay, il talentuoso e disponibile steward di laboratorio. Credito: J. B. Birks, ed.,, Rutherford at Manchester (Londra: Heywood & Co., 1962), di fronte a p. 38.
Rutherford riuniva sempre un gruppo di brillanti giovani ricercatori intorno a lui. In questa foto di gruppo del 1910 sono Ernest Marsden e Hans Geiger. Davanti e al centro sono i professori Schuster e Rutherford, e centrato nella parte posteriore è William Kay, il talentuoso e disponibile steward di laboratorio. Credito: J. B. Birks, ed.,, Rutherford at Manchester (Londra: Heywood & Co., 1962), di fronte a p. 38.
La prima squadra di Rutherford a Manchester comprendeva Geiger e William Kay (1879-1961), assistente di laboratorio junior dal 1894. Rutherford promosso Kay a amministratore di laboratorio nel 1908, per gestire attrezzature di laboratorio e per aiutarlo nella sua ricerca. Nel 1957, Kay ripensò alla sua giovinezza con Rutherford in un’intervista. Il linguaggio è caratteristico,ma la descrizione è il più vicino all’approccio di Rutherford., L’interrogante era Samuel Devons (1914-2006), che fu uno degli ultimi studenti di Rutherford negli anni ‘ 30.
 Hans Geiger fu il principale partner di Rutherford nella ricerca sui raggi alfa dal 1907 al 1913. Insieme hanno sviluppato diversi modi per rilevare i raggi alfa. Hanno dimostrato che i raggi alfa sono nuclei di elio doppiamente ionizzati. Ca. 1908. Credito: AIP Emilio Segre Archivi visivi, Fisica Oggi Collezione.
Hans Geiger fu il principale partner di Rutherford nella ricerca sui raggi alfa dal 1907 al 1913. Insieme hanno sviluppato diversi modi per rilevare i raggi alfa. Hanno dimostrato che i raggi alfa sono nuclei di elio doppiamente ionizzati. Ca. 1908. Credito: AIP Emilio Segre Archivi visivi, Fisica Oggi Collezione.
Rutherford e Hans Geiger hanno lavorato a stretto contatto nel 1907 e nel 1908 sulla rilevazione e la misurazione di particelle α., Se dovessero usare particelle α per sondare l’atomo, dovevano prima saperne di più su queste particelle e sul loro comportamento. Rutherford aveva provato e fallito a McGill per contare le particelle α.
Un anno dopo a Manchester, lui e Geiger riuscirono con due metodi di osservazione delle particelle α. Il primo metodo prevedeva scintillazioni eccitate da particelle α su un sottile strato di solfuro di zinco. Hanno osservato questi attraverso un microscopio e contato le scintillazioni a diversi angoli di dispersione., Hanno anche sviluppato un “elettrometro” che potrebbe dimostrare il passaggio di una singola particella α a un vasto pubblico. Lo strumento, che si è evoluto nel “contatore Geiger”, aveva un cilindro metallico parzialmente evacuato con un filo al centro. Hanno applicato una tensione tra il cilindro e il filo abbastanza alta quasi a scintilla. Hanno ammesso le particelle α attraverso una sottile finestra di mica, dove queste particelle si sono scontrate con i gas, producendo ioni di gas. Questi poi si sono scontrati con altre molecole e hanno prodotto più ioni, e così via., Ogni particella α produceva una cascata di ioni, che scaricava parzialmente il cilindro e indicava il passaggio di una particella α. Geiger e Rutherford pubblicato diversi articoli nel 1908 e 1909 su questi metodi e il loro uso.
Rutherford scrisse a Henry Bumstead (1870-1920), un fisico americano, l ‘ 11 luglio 1908:
Geiger è un uomo buono e ha lavorato come uno schiavo. Non avrei mai potuto trovare il tempo per la fatica prima di fare le cose in grande stile. Finalmente tutto è andato bene, ma la dispersione è il diavolo. Il nostro tubo ha funzionato come un fascino e potremmo facilmente ottenere un tiro di 50 mm., per ogni particella. … Geiger è un demone al lavoro di contare le scintillazioni e poteva contare a intervalli per un’intera notte senza disturbare la sua equanimità. Ho dannato vigorosamente e mi sono ritirato dopo due minuti. (Citato in Eve, p. 180.Sebbene Rutherford sospettasse già nel 1906 che le particelle α fossero atomi di elio spogliati dei loro elettroni, chiese un alto livello di prova. Un tipo di esperimento non era sufficiente. Un tipo di rivelatore non era sufficiente. Voleva altre prove., Per questo, Rutherford desiderava “grandi tensioni” e grandi elettromagneti per deviare le particelle α, ma questo metodo non era ancora maturo. Lo steward del laboratorio William Kay ricordò nella citata oral history interview che Rutherford nel 1908 insistette che erano necessari forti campi elettrici e magnetici per misurare più direttamente la carica e la massa delle particelle α e β:
Kay disse che Rutherford voleva un grande magnete raffreddato ad acqua, ma che “lo lasciò cadere come una torta calda” quando ne apprese il costo. Quindi aveva bisogno di una nuova linea di attacco. La nuova linea era molto semplice, una procedura chimica mescolata con la fisica., Per questo lavoro Rutherford reclutato Thomas Royds (1884-1955), che aveva conseguito la sua Fisica Honours laurea nel 1906. Raccoglievano particelle α in un tubo di vetro sigillato, le comprimevano e passavano attraverso una scintilla elettrica. Hanno studiato la luce emessa in uno spettroscopio e hanno scoperto che era identica allo spettro dell’elio. Nel giro di pochi mesi, Rutherford è stato assegnato il Premio Nobel per la Chimica, “per le sue indagini sulla disintegrazione degli elementi, e la chimica delle sostanze radioattive., Rutherford e Royds avevano stabilito l’identità e le proprietà primarie delle particelle α. Rutherford poi rivolse la sua attenzione al loro utilizzo per sondare l’atomo.
Nell’autunno del 1908 iniziò un’importante serie di ricerche. Geiger aveva passato fasci di particelle α attraverso l’oro e altri fogli metallici, utilizzando le nuove tecniche di rilevamento per misurare quanto questi fasci sono stati dispersi dagli atomi nei fogli. Geiger pensava Ernest Marsden (1889-1970), uno studente di 19 anni in Fisica Honours, era pronto ad aiutare su questi esperimenti e lo suggerì a Rutherford., Dal momento che Rutherford spesso spinto gli studenti del terzo anno in ricerca, dicendo che questo era il modo migliore per conoscere la fisica, ha prontamente accettato.
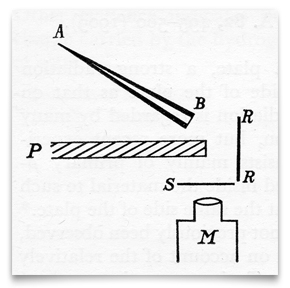 Questo schizzo, tratto dall’articolo di Geiger e Marsden del 1909, mostra un tubo di vetro conico pieno di “emanazione del radio” (radon), chiuso a B con un sottile vetro di mica. Questa era la loro fonte di particelle alfa (α). S era uno schermo di zinco-solfuro, che scintillava quando colpito da una particella α. P era uno schermo di piombo, che impediva a qualsiasi particella α di viaggiare direttamente allo schermo di zinco-solfuro., RR era una lamina (o lamine) di metalli diversi (compreso l’oro) che “rifletteva diffusamente” le particelle α incidente. Geiger e Marsden osservarono le scintillazioni risultanti attraverso un microscopio osservante, M. Credit: H. Geiger e E. Marsden, “Su una riflessione diffusa delle particelle α”, Proceedings of the Royal Society,1909, 82:495-500.
Questo schizzo, tratto dall’articolo di Geiger e Marsden del 1909, mostra un tubo di vetro conico pieno di “emanazione del radio” (radon), chiuso a B con un sottile vetro di mica. Questa era la loro fonte di particelle alfa (α). S era uno schermo di zinco-solfuro, che scintillava quando colpito da una particella α. P era uno schermo di piombo, che impediva a qualsiasi particella α di viaggiare direttamente allo schermo di zinco-solfuro., RR era una lamina (o lamine) di metalli diversi (compreso l’oro) che “rifletteva diffusamente” le particelle α incidente. Geiger e Marsden osservarono le scintillazioni risultanti attraverso un microscopio osservante, M. Credit: H. Geiger e E. Marsden, “Su una riflessione diffusa delle particelle α”, Proceedings of the Royal Society,1909, 82:495-500.
Geiger e Marsden iniziarono con la dispersione a piccolo angolo e provarono vari spessori di fogli, cercando relazioni matematiche tra dispersione e spessore della lamina o numero di atomi attraversati., Marsden in seguito ricordò che Rutherford gli disse in mezzo a questi esperimenti: “Vedi se puoi ottenere qualche effetto delle particelle alfa riflesse direttamente da una superficie metallica.”(Riportato da Marsden in Birks, 1962, p. 8). Marsden dubitava che Rutherford si aspettasse una nuova dispersione di particelle α, ma come Marsden scrisse
was era una di quelle “intuizioni” che forse si poteva osservare un qualche effetto, e che in ogni caso il territorio confinante di questo terreno di Tom Tiddler poteva essere esplorato mediante ricognizione., Rutherford era sempre pronto a soddisfare l’inaspettato e sfruttarlo, dove favorevole, ma sapeva anche quando fermarsi in tali escursioni. (Birks, 1962, p. 8)
Questo era l’approccio giocoso di Rutherford in azione. I suoi studenti e altri hanno provato le sue idee, molte delle quali erano vicoli ciechi. Questa idea di cercare il backscattering delle particelle α, tuttavia, ha dato i suoi frutti., Rutherford ha scritto:
L’esperimento, diretto dall’immaginazione disciplinata di un individuo o, meglio ancora, di un gruppo di individui di varia prospettiva mentale, è in grado di ottenere risultati che trascendono di gran lunga la sola immaginazione del più grande filosofo. (Citato in Eve, 1939, Frontmatter)
Qualche tempo dopo, nel 1908 o nel 1909, Marsden ha detto, ha riferito i suoi risultati a Rutherford. Rutherford lo ha ricordato in modo un po ‘ diverso:
Ricordo …più tardi Geiger venne da me con grande eccitazione e disse: “Siamo stati in grado di far tornare indietro alcune delle particelle α…,”E’ stato l’evento più incredibile che mi sia mai successo in vita mia. È stato quasi incredibile come se avessi sparato un guscio da 15 pollici a un pezzo di carta velina e fosse tornato indietro e ti avesse colpito. (Rutherford, 1938, p. 68)
La memoria umana è fallibile. Sia Marsden o Geiger detto Rutherford, l’effetto è stato lo stesso. Rutherford ha detto che dovrebbero preparare una pubblicazione da questa ricerca, che hanno presentato nel maggio 1909. Inoltre, questo ha iniziato Rutherford pensando verso ciò che in ultima analisi, quasi due anni dopo, ha pubblicato come una teoria dell’atomo.,
Cosa stava facendo Rutherford per il resto del 1909 e per tutto il 1910? Per prima cosa, il suo caro amico Boltwood era a Manchester per l’anno accademico lavorando con Rutherford sui prodotti di decadimento radioattivo del radio. Stava anche rivedendo e parlando di idee precedenti sulla struttura atomica. Ancora più importante, stava prendendo il fenomeno della dispersione di particelle α a parte sistematicamente e testando ogni pezzo. Rutherford non ebbe la sua idea audace — l’atomo nucleare — all’istante, ma vi arrivò gradualmente considerando il problema da più parti.,
Nell’autunno del 1910 portò Marsden di nuovo a Manchester per completare rigorosi test sperimentali delle sue idee con Geiger. Hanno ristabilito i tassi di emissione e gli intervalli di particelle α da fonti radioattive e hanno riesaminato le loro analisi statistiche. Rutherford cercò di conciliare i risultati di scattering con diversi modelli atomici, in particolare quello di JJ Thomson, in cui l’elettricità positiva era considerata dispersa uniformemente su tutta la sfera dell’atomo.
 Una pagina delle prime note di Rutherford, non datate (1910 o 1911)., Le prime righe recitano: “Teoria della struttura dell’atomo. Supponiamo che l’atomo sia costituito da + carica ne al centro & di – carica come elettrone distribuito in tutta la sfera del raggio r. ” Ha quindi elaborato idee sul calcolo della forza di deflessione su una particella carica che passa vicino a questo centro carico. Credito: J. B. Birks, ed., Rutherford at Manchester (Londra: Heywood & Co., 1962), p. 70.
Una pagina delle prime note di Rutherford, non datate (1910 o 1911)., Le prime righe recitano: “Teoria della struttura dell’atomo. Supponiamo che l’atomo sia costituito da + carica ne al centro & di – carica come elettrone distribuito in tutta la sfera del raggio r. ” Ha quindi elaborato idee sul calcolo della forza di deflessione su una particella carica che passa vicino a questo centro carico. Credito: J. B. Birks, ed., Rutherford at Manchester (Londra: Heywood & Co., 1962), p. 70.
Ad un certo punto nell’inverno del 1910-1911, Rutherford elaborò l’idea di base di un atomo con un “centro carico.,”Come Geiger e Marsden hanno sottolineato nel loro articolo del 1909:
Se si tiene conto dell’alta velocità e della massa della particella α, sembra sorprendente che alcune delle particelle α, come mostra l’esperimento, possano essere ruotate all’interno di uno strato di 6 x 10-5 cm. di oro attraverso un angolo di 90°, e anche di più. Per produrre un effetto simile da un campo magnetico, sarebbe necessario l’enorme campo di 109 unità assolute. (Birks, pag., 179)
Rutherford concluse nel suo articolo del maggio 1911 che una deviazione così notevole nel percorso di una particella carica massiccia poteva essere raggiunta solo se la maggior parte della massa di, diciamo, un atomo d’oro e la maggior parte della sua carica erano concentrati in un corpo centrale molto piccolo. Nota: a questo punto nel 1911, Rutherford non ha chiamato questo un ” nucleo.”
Hai bisogno di Flash Player installato per ascoltare questo clip audio.,
Il primo annuncio pubblico della teoria nucleare da parte di Rutherford fu fatto in una riunione della Manchester Literary and Philosophical Society, e invitò noi giovani ragazzi ad andare all’incontro. Ha detto che aveva delle cose interessanti da dire e ha pensato che ci sarebbe piaciuto sentirle. Non sapevamo di cosa si trattasse in quel momento. Le persone anziane in laboratorio hanno fatto, naturalmente Geiger e Marsden sapevano perché stavano già facendo gli esperimenti. Infatti, a meno che non avessero fatto alcuni che erano sufficienti per essere decisivo, Rutherford mai menzionato pubblicamente., E, naturalmente, Darwin lo sapeva molto prima. Ma doveva essere all’inizio del 1911, andammo all’adunanza e lui ce lo disse. E menzionò allora che c’erano alcune prove sperimentali che erano state ottenute da Geiger e Marsden. Per quanto mi ricordo, non ha detto di più sui risultati che sono stati abbastanza decisivi. E, come ho detto prima, non avrebbe mai fatto un annuncio pubblico di quel tipo se non avesse avuto buone prove., E questa è una delle caratteristiche che attraversa tutto il lavoro di Rutherford, in particolare tutto il suo lavoro fino alla fine del periodo di Manchester. Se si guardano alcuni dei suoi documenti nei primi giorni-io chiamo McGill i primi giorni-era abbastanza convinto che le particelle alfa erano atomi di elio, ma non ha mai detto che in quelle parole. Ha sempre detto che erano atomi di elio o molecole di idrogeno o forse potrebbe aver detto qualcos’altro di quel peso., Era piuttosto caratteristico di lui che non avrebbe mai detto che una cosa era così a meno che non avesse prove sperimentali che lo soddisfacessero davvero.
Infatti, Rutherford fu estremamente cauto nel trarre conclusioni su questa carica centrale: “Un semplice calcolo mostra che l’atomo deve essere una sede di un intenso campo elettrico per produrre una deflessione così grande in un singolo incontro.”(Birks, p. 183). Ha elaborato rapidamente e approssimativamente che diverse relazioni quantitative dovrebbero essere vere se questa teoria di base fosse corretta., Innanzitutto, il numero di particelle α sparse attraverso un determinato angolo dovrebbe essere proporzionale allo spessore della lamina. In secondo luogo, quel numero dovrebbe essere proporzionale al quadrato della carica nucleare. Infine, dovrebbe essere inversamente proporzionale alla quarta potenza della velocità della particella α. Queste tre idee hanno presentato il programma sperimentale di Geiger e Marsden per il prossimo anno.
È necessario installare Flash Player per ascoltare questa clip audio.,
L’interesse di Rutherford era quindi quasi interamente nella ricerca. Aveva fatto pochissimo insegnamento a McGill. Era professore di ricerca. Suppongo che ha dato alcune conferenze, ma sarebbe stato molto pochi. E il suo interesse era abbastanza naturale sul lato della ricerca. Ha dato alcune conferenze, ma lezioni elementari, il genere di cose che ci si aspetterebbe che un uomo sappia prima di venire all’Università. Erano le lezioni agli ingegneri. Erano un sacco chiassoso e Rutherford potrebbe tenerli sotto controllo., C’era forse solo un altro uomo nel dipartimento che avrebbe potuto farlo, e lui (Rutherford?) li ha apprezzati perché è stato in grado di mostrare loro gli esperimenti molto interessanti che si possono eseguire nei corsi elementari.
Mi è stato spesso detto che Rutherford era un cattivo docente. Non ho mai sentito queste sciocchezze. E ‘vero che a volte sarebbe stato un po’ noioso, un po ‘ confuso, ma questo è stato solo in rarissime occasioni. Ci sono state altre occasioni in cui è stato davvero più stimolante. C’era un enorme entusiasmo in lui.,
Rutherford intrattenuto la possibilità che il centro carica è negativo. Sembra strano oggi, quindi cosa lo ha reso ragionevole? Innanzitutto, non era molto diverso dal modello di Thomson. In secondo luogo, poiché Rutherford sapeva che le particelle α trasportano una carica doppia+, pensava che questo potesse agire allo stesso modo del Sole su una cometa che spazzava vicino ad essa. Sarebbe fionda la particella α intorno e indietro verso la sua fonte. Ha anche considerato un modello quasi dimenticato suggerito dal fisico giapponese Hantaro Nagaoka (1865-1950) – il modello Saturniano., Nagaoka e Rutherford furono in contatto nel 1910 e nel 1911 e Rutherford menzionò il modello di Nagaoka di “una massa centrale che attira l’attenzione di anelli di elettroni rotanti” (Birks, p. 203). Il risultato finale in questo articolo critico di Rutherford, tuttavia, fu l’annuncio di Rutherford che se l’atomo fosse un disco o una sfera, e in effetti se la carica centrale fosse positiva o negativa, non avrebbe influenzato i calcoli. Rutherford era sempre attento a non rivendicare più di quanto i suoi risultati potessero supportare.,
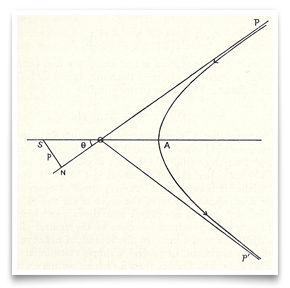 Nell’ormai famoso articolo di Rutherford del maggio 1911 sulla dispersione delle particelle alfa mediante lamina d’oro, incluse questo schizzo del percorso iperbolico di una particella. Credit: E. Rutherford, “The Scattering of α and β Particles by Matter and the Structure of Matter,” Philosophical Magazine, 1911, 21: 669-688.Rutherford ha visto possibili test sulla natura della carica centrale. L’assorbimento delle particelle β, ha detto, dovrebbe essere diverso con un centro negativo rispetto a uno positivo., Un centro positivo spiegherebbe la grande velocità che le particelle α raggiungono durante l’emissione da elementi radioattivi. Ma questi erano solo suggerimenti.
Nell’ormai famoso articolo di Rutherford del maggio 1911 sulla dispersione delle particelle alfa mediante lamina d’oro, incluse questo schizzo del percorso iperbolico di una particella. Credit: E. Rutherford, “The Scattering of α and β Particles by Matter and the Structure of Matter,” Philosophical Magazine, 1911, 21: 669-688.Rutherford ha visto possibili test sulla natura della carica centrale. L’assorbimento delle particelle β, ha detto, dovrebbe essere diverso con un centro negativo rispetto a uno positivo., Un centro positivo spiegherebbe la grande velocità che le particelle α raggiungono durante l’emissione da elementi radioattivi. Ma questi erano solo suggerimenti.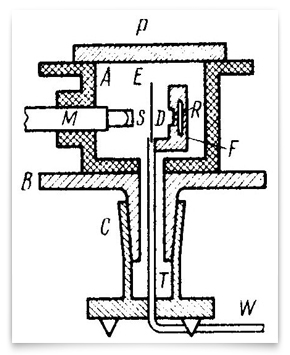 Questo schema rappresenta gli esperimenti raffinati del 1912-13 intrapresi da Geiger e Marsden. R era la fonte di particelle alfa, E era la lamina d’oro, e M era il microscopio ruotabile attorno ad un asse verticale centrato sulla lamina d’oro. Particelle alfa dalla sorgente passati attraverso il diaframma D, sono stati sparsi dal foglio, e sono stati osservati come scintillazioni sullo schermo S., Geiger e Marsden hanno osservato gli angoli delle particelle sparse ruotando il gruppo microscopio-schermo. Credito: H. Geiger e E. Marsden, “Le leggi della deflessione delle particelle α attraverso grandi angoli”, Rivista filosofica, 1913, 25: 604-623.
Questo schema rappresenta gli esperimenti raffinati del 1912-13 intrapresi da Geiger e Marsden. R era la fonte di particelle alfa, E era la lamina d’oro, e M era il microscopio ruotabile attorno ad un asse verticale centrato sulla lamina d’oro. Particelle alfa dalla sorgente passati attraverso il diaframma D, sono stati sparsi dal foglio, e sono stati osservati come scintillazioni sullo schermo S., Geiger e Marsden hanno osservato gli angoli delle particelle sparse ruotando il gruppo microscopio-schermo. Credito: H. Geiger e E. Marsden, “Le leggi della deflessione delle particelle α attraverso grandi angoli”, Rivista filosofica, 1913, 25: 604-623.
Geiger e Marsden hanno effettivamente lavorato sistematicamente attraverso le implicazioni verificabili dell’ipotesi di carica centrale di Rutherford. La prima pubblicazione importante dei loro risultati fu in tedesco negli Atti dell’Accademia delle Scienze di Vienna (Sitzungberichte der Wiener Akademie der Wissenschaften) nel 1912., Questa versione di 30 pagine fu seguita da una in inglese nel 1913 nella rivista Philosophical: “The Laws of Deflexion of α Particles through Large Angles” La versione inglese è la più conosciuta. Lievi differenze tra i due portarono uno storico a suggerire che Rutherford decise a favore di un centro con carica positiva entro l’agosto 1912 (Trenn, 1974). Gli altri membri del team di Rutherford, in particolare Charles Galton Darwin (1887-1962), H. G. J. Moseley (1887-1915) e Niels Bohr (1885-1962) figurarono in primo piano nella creazione definitiva dell’atomo nucleare di Rutherford.,
 Il giovane Henry G. J. Moseley, nel Balliol-Trinity Laboratory, Oxford, ca. 1910. Più tardi quell’anno, Moseley iniziò la ricerca nel laboratorio di Rutherford a Manchester. La sua brillante carriera fu interrotta in combattimento durante la prima guerra mondiale.Credit: University of Oxford, Museum of the History of Science, courtesy AIP Emilio Segrè Visual Archives, Physics Today Collection.
Il giovane Henry G. J. Moseley, nel Balliol-Trinity Laboratory, Oxford, ca. 1910. Più tardi quell’anno, Moseley iniziò la ricerca nel laboratorio di Rutherford a Manchester. La sua brillante carriera fu interrotta in combattimento durante la prima guerra mondiale.Credit: University of Oxford, Museum of the History of Science, courtesy AIP Emilio Segrè Visual Archives, Physics Today Collection.
La ‘Grande Guerra’ ha completamente interrotto il lavoro nel dipartimento di Manchester di Rutherford. Bohr tornò in Danimarca. Marsden ha accettato una cattedra in Nuova Zelanda. Moseley morì nella battaglia di Gallipoli., James Chadwick (1891-1974), che stava lavorando con Geiger all’Università Tecnica di Berlino quando scoppiò la guerra, trascorse diversi anni internato nel campo di Ruhleben per prigionieri di guerra. Anche altri studenti partirono per la guerra, e Rutherford dedicò notevoli energie alla mobilitazione della scienza per lo sforzo bellico e in particolare alle tecniche anti-sottomarini.
 Niels Bohr lavorò per la prima volta con Rutherford a Manchester nel 1912. Questa foto mostra i giovani Niels e Margrethe Bohr, ca., 1914, quando Bohr succedette a Charles Galton Darwin come lettore di Schuster in Fisica Matematica a Manchester. Credit: AIP Emilio Segre Visual Archives, Collezione Margrethe Bohr.
Niels Bohr lavorò per la prima volta con Rutherford a Manchester nel 1912. Questa foto mostra i giovani Niels e Margrethe Bohr, ca., 1914, quando Bohr succedette a Charles Galton Darwin come lettore di Schuster in Fisica Matematica a Manchester. Credit: AIP Emilio Segre Visual Archives, Collezione Margrethe Bohr.
In questo contesto distratto, Rutherford e il suo amministratore di laboratorio, William Kay, iniziarono nel 1917 ad esplorare il passaggio di particelle α attraverso idrogeno, azoto e altri gas. Quando la Grande Guerra finì, Ernest Marsden aiutò brevemente con le noiose osservazioni di scintillazione che fornivano indizi sulla natura del nucleo. Rutherford riferì i risultati provvisori di questi ampi esperimenti nel 1919., Rutherford mise una sorgente di radio C (bismuth-214) in un contenitore di ottone sigillabile, montato in modo che la posizione della sorgente potesse essere cambiata e in modo che diversi gas potessero essere introdotti o prodotti sotto vuoto, a piacere. Le particelle α attraversarono l’interno del contenitore e passarono attraverso una fessura, coperta da una piastra d’argento o altro materiale, e colpirono uno schermo di solfuro di zinco, dove fu osservata una scintillazione in una stanza buia. Quando l’idrogeno gassoso è stato introdotto nel contenitore e si è prestata attenzione ad assorbire le particelle α prima che colpissero lo schermo, sono state ancora osservate scintillazioni., Rutherford postulò che mentre le particelle α attraversavano il gas idrogeno, occasionalmente entravano in collisione con i nuclei di idrogeno. Come scrisse Rutherford, questo produsse “atomi di idrogeno rapidi” che erano per lo più proiettati in avanti nella direzione del moto originale delle particelle α.
Rutherford aveva in mente diverse domande sottili durante questi esperimenti, per lo più riguardanti la natura del nucleo., Ha chiesto al suo collega Darwin di analizzare queste collisioni basate su una “teoria semplice” di collisioni elastiche tra nuclei puntiformi respinti secondo una legge quadrata inversa, le particelle α che trasportano una carica di 2 volte quella di un elettrone (e di segno opposto) e i nuclei di idrogeno 1 volte. Darwin ha scoperto che tutte le particelle α che si avvicinano entro 2. 4×10-13 cm produrrebbe un ‘ atomo di idrogeno rapido.”Questa semplice teoria, tuttavia, prevedeva molti meno atomi di idrogeno accelerati di quelli osservati negli esperimenti.,
Rutherford respinse le spiegazioni di questa varianza basate su cariche diverse sulle particelle o altre leggi rispetto alle leggi quadrate inverse. Piuttosto, ha concluso che per distanze dell’ordine del diametro dell’elettrone, ” la struttura del nucleo di elio non può più essere considerata come un punto…”. Ha postulato che il nucleo di elio (particella α) ha una struttura complessa di quattro nuclei di idrogeno più due elettroni caricati negativamente. (Diremmo che è composto da due protoni., Rutherford concluse che la deformazione dei nuclei complessi durante le collisioni era una spiegazione più probabile, la variazione delle forze tra i nuclei che variavano in modo complesso all’approccio ravvicinato.
Tenendo conto delle intense forze messe in gioco in tali collisioni, non sarebbe sorprendente se il nucleo di elio dovesse rompersi. Nessuna prova di tale disintegrazione indicating è stata osservata, indicando che il nucleo di elio deve essere una struttura molto stabile.,
Dobbiamo ricordare che Rutherford non poteva osservare direttamente la struttura del nucleo, quindi le sue conclusioni erano provvisorie. Tuttavia, stava apertamente considerando le possibilità di un nucleo complesso, capace di deformazione e persino di possibile disintegrazione. Questi pensieri hanno plasmato questo intenso periodo di ricerche sperimentali.