Configurazione elettronica
Gli elettroni in un atomo riempiono i suoi orbitali atomici secondo il principio Aufbau; “Aufbau”, in tedesco, significa “costruire.”Il principio di Aufbau, che incorpora il principio di esclusione di Pauli e la Regola di Hund prescrive alcune semplici regole per determinare l’ordine in cui gli elettroni riempiono gli orbitali atomici:
- Gli elettroni riempiono sempre gli orbitali di energia inferiore per primi. 1s è riempito prima di 2s e 2s prima di 2p.,
- Il principio di esclusione di Pauli afferma che due elettroni all’interno di un particolare atomo possono avere numeri quantici identici. In funzione, questo principio significa che se due elettroni occupano lo stesso orbitale, devono avere spin opposto.
- La Regola di Hund afferma che quando un elettrone si unisce a un atomo e deve scegliere tra due o più orbitali della stessa energia, l’elettrone preferirà entrare in un orbitale vuoto piuttosto che in uno già occupato., Poiché più elettroni vengono aggiunti all’atomo, questi elettroni tendono a riempire a metà gli orbitali della stessa energia prima di accoppiarsi con gli elettroni esistenti per riempire gli orbitali.
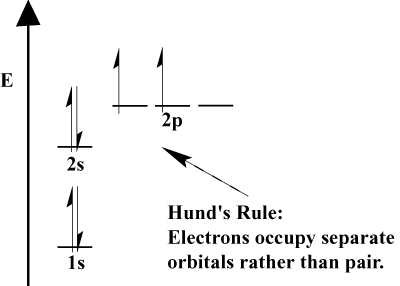
Elettroni di valenza e valenza
Il guscio orbitale più esterno di un atomo è chiamato il suo guscio di valenza, e gli elettroni nel guscio di valenza sono elettroni di valenza. Gli elettroni di valenza sono gli elettroni di energia più alti in un atomo e sono quindi i più reattivi. Mentre gli elettroni interni (quelli non nel guscio di valenza) in genere non partecipano al legame chimico e alle reazioni, gli elettroni di valenza possono essere acquisiti, persi o condivisi per formare legami chimici., Per questo motivo, gli elementi con lo stesso numero di elettroni di valenza tendono ad avere proprietà chimiche simili, poiché tendono a guadagnare, perdere o condividere elettroni di valenza allo stesso modo. La Tavola periodica è stata progettata con questa caratteristica in mente. Ogni elemento ha un numero di elettroni di valenza uguale al suo numero di gruppo sulla Tavola periodica.
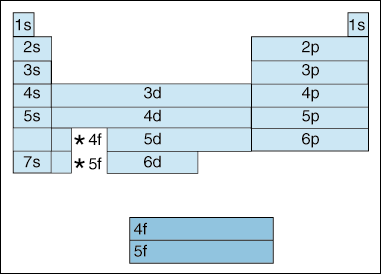
Questa tabella illustra una serie di interessanti e complicando, caratteristiche della configurazione elettronica.,
In primo luogo, quando gli elettroni diventano più alti in energia, avviene uno spostamento. Fino ad ora, abbiamo detto che, come il numero quantico principio, aumenta, così fa il livello di energia dell’orbitale. E, come abbiamo detto sopra nel principio di Aufbau, gli elettroni riempiono orbitali a energia inferiore prima di riempire orbitali a energia superiore. Tuttavia, il diagramma sopra mostra chiaramente che l’orbitale 4s è riempito prima dell’orbitale 3d., In altre parole, una volta arrivati al principio numero quantico 3, le subshell più alte dei numeri quantici inferiori eclissano in energia le subshell più basse dei numeri quantici superiori: 3d è di energia superiore a 4s.
In secondo luogo, quanto sopra indica un metodo per descrivere un elemento secondo la sua configurazione elettronica. Mentre ci si sposta da sinistra a destra attraverso la tavola periodica, il diagramma sopra mostra l’ordine in cui gli orbitali sono riempiti. Se fossimo effettivamente abbattere il diagramma sopra in gruppi piuttosto che i blocchi che abbiamo, mostrerebbe esattamente quanti elettroni ha ogni elemento., Ad esempio, l’elemento dell’idrogeno, situato nell’angolo più alto a sinistra della tavola periodica, è descritto come 1s1, con la s che descrive quale orbitale contiene elettroni e l ‘ 1 che descrive quanti elettroni risiedono in quell’orbitale. Il litio, che risiede sulla tavola periodica appena sotto l’idrogeno, sarebbe descritto come 1s22s1. Le configurazioni di elettroni dei primi dieci elementi sono mostrate di seguito (si noti che gli elettroni di valenza sono l’elettrone nel guscio di energia più alto, non solo gli elettroni nella sottoscocca di energia più alta).,

La regola dell’ottetto
La nostra discussione sulle configurazioni degli elettroni di valenza ci porta ad uno dei principi cardine del legame chimico, la regola dell’ottetto. La regola dell’ottetto afferma che gli atomi diventanoparticolarmente stabile quando i loro gusci di valenza ottengono un complemento completo di elettroni di valenza. Ad esempio, in sopra, Elio (He) e Neon (Ne) hanno gusci di valenza esterni che sono completamente riempiti, quindi nessuno dei due ha la tendenza a guadagnare o perdere elettroni., Pertanto, Elio e Neon, due dei cosiddetti gas nobili, esistono in forma atomica libera e di solito non formano legami chimici con altri atomi.
La maggior parte degli elementi, tuttavia, non hanno un guscio esterno completo e sono troppo instabili per esistere come atomi liberi. Invece cercano di riempire i loro gusci di elettroni esterni formando legami chimici con altri atomi e quindi ottenere una configurazione di Gas nobile. Un elemento tenderà a prendere il percorso più breve per raggiungere la configurazione del Gas nobile, sia che ciò significhi guadagnare o perdere un elettrone., Ad esempio, il sodio (Na), che ha un singolo elettrone nel suo orbitale 3s esterno, può perdere quell’elettrone per raggiungere la configurazione elettronica del neon. Cloro, con sette elettroni di valenza, può ottenere un elettrone per raggiungere la configurazione di argon. Quando due elementi diversi hanno la stessa configurazione elettronica, sono chiamati isoelettronici.
Diamagnetismo e Paramagnetismo
La configurazione elettronica di un atomo ha anche conseguenze sul suo comportamento in relazione ai campi magnetici. Tale comportamento dipende dal numero di elettroni che un atomo ha che sono spin accoppiato., Ricorda che la Regola di Hund e il principio di esclusione di Pauli si combinano per dettare che gli orbitali di un atomo si riempiranno tutti a metà prima di iniziare a riempirsi completamente, e che quando si riempiranno completamente di due elettroni, quei due elettroni avranno spin opposti.
Un atomo con tutti i suoi orbitali pieni, e quindi tutti i suoi elettroni accoppiati con un elettrone di spin opposto, sarà molto poco influenzato dai campi magnetici. Tali atomi sono chiamati diagrammetici. Al contrario, gli atomi paramagnetici non hanno tutti i loro elettroni spin-accoppiati e sono influenzati dai campi magnetici., Ci sono gradi di paramagnetismo, dal momento che un atomo potrebbe avere un elettrone spaiato, o potrebbe avere quattro.