niet alle botsingen zijn gelijk
voor een gas bij kamertemperatuur en normale atmosferische druk zijn er ongeveer 1033 botsingen per kubieke centimeter ruimte per seconde. Als elke botsing tussen twee reactantmoleculen producten opleverde, zouden alle reacties in een fractie van een seconde compleet zijn. Bijvoorbeeld, wanneer twee biljartballen botsen, stuiteren ze gewoon van elkaar af., Dit is de meest waarschijnlijke uitkomst als de reactie tussen A en B een significante verstoring of herschikking van de bindingen tussen hun atomen vereist. Om een reactie effectief te kunnen initiëren, moeten botsingen voldoende energetisch zijn (of voldoende kinetische energie hebben) om deze binding te verstoren. Dit wordt hieronder verder besproken.
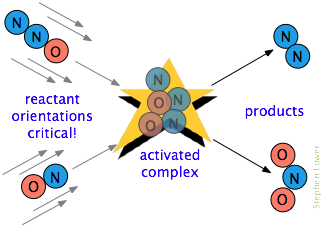
Er is vaak één extra vereiste. In veel reacties, vooral die waarbij complexere moleculen betrokken zijn, moet de reagerende soort op een voor het specifieke proces geschikte manier worden georiënteerd., Bijvoorbeeld, in de gas-fase reactie van dinitrogeenoxide met stikstofmonoxide, moet het zuurstofeinde van N2O het stikstofeinde van NO raken; het veranderen van de oriëntatie van een van beide moleculen verhindert de reactie. Door de uitgebreide randomisatie van moleculaire bewegingen in een gas of vloeistof, zijn er altijd voldoende correct georiënteerde moleculen voor sommige moleculen om te reageren. Hoe kritischer deze oriëntatievereiste is, hoe minder botsingen effectief zullen zijn.,
energetische botsingen tussen moleculen zorgen ervoor dat interatomische bindingen rekken en buigen, waardoor ze tijdelijk verzwakken zodat ze gevoeliger worden voor splitsing. De vervorming van de bindingen kan hun verbonden elektronenwolken aan interactie met andere reactanten blootstellen die tot de vorming van nieuwe bindingen zouden kunnen leiden.,
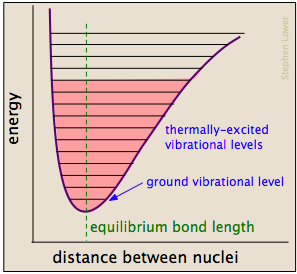
chemische bindingen hebben enkele eigenschappen van mechanische veren: hun potentiële energie is afhankelijk van de mate waarin ze worden uitgerekt of gecomprimeerd. Elke atoom-tot-atoom binding kan worden beschreven door een potentiaalenergiediagram dat laat zien hoe zijn energie verandert met zijn lengte., Wanneer de band energie absorbeert (hetzij door verwarming of door een botsing), wordt het verhoogd tot een hogere gekwantiseerde trillingstoestand (aangegeven door de horizontale lijnen) die de band verzwakt als zijn lengte oscilleert tussen de verlengde grenzen die overeenkomen met de kromme.
een bepaalde botsing zal op deze manier een aantal bindingen opwekken. Binnen ongeveer 10-13 seconden, wordt deze opwinding verdeeld onder de andere banden in de molecule op complexe en onvoorspelbare manieren die de toegevoegde energie op een bijzonder kwetsbaar punt kunnen concentreren., De aangetaste band kan verder rekken en buigen, waardoor het gevoeliger is voor splitsing. Zelfs als de band niet breekt door puur uitrekken, kan het vervormd of gedraaid worden om nabijgelegen elektronenwolken bloot te stellen aan interacties met andere reactanten die een reactie zouden kunnen aanmoedigen.