Rutherford at Manchester, 1907-1919
Ernest Rutherford ontdekte de kern van het atoom in 1911. We lezen dit in schoolboeken en in populaire geschriften. Maar wat betekent die verklaring? Geografische ontdekking betekent meestal dat men ziet een plaats voor de eerste keer. Maar kan ontdekking hetzelfde zijn voor een rijk dat aan het zicht is onttrokken? Men kan geen atoom in die zin zien., Dit duidt erop dat het verhaal van de ontdekking van de kern misschien ingewikkelder was. Het verhaal zoals het zich ontvouwde in Rutherford ‘ s lab aan de Universiteit in Manchester draaide om echte mensen. Het ging om frustraties en triomfen. Het ging om hard werken en verbijstering en inspiratie.toen Rutherford in 1907 hoogleraar werd aan Manchester, vond hij moderne laboratoria voor onderwijs en onderzoek. Op aandringen van zijn voorganger, Arthur Schuster, werd meer dan £40.000 opgehaald om het natuurkundeprogramma te bekostigen. Ter vergelijking, Rutherford ‘ s royale salaris was £ 1.600 / jaar., Credit: uit het boek: The physical laboratories of the University Of Manchester: a record of 25 years ‘ work by the University of Manchester, Manchester: At the University Press, 1906. AIP Emilio Segrè Visual Archives, collectie brosse boeken.Rutherford arriveerde in Manchester in de zomer van 1907, maanden voordat de termijn van de universiteit begon. Hij was benoemd tot Langworthy Professor of Physics, opvolger van Arthur Schuster (1851-1934), die op 56-jarige leeftijd met pensioen ging om Rutherford te rekruteren. Schuster had een modern natuurkundegebouw gebouwd, huurde Hans Geiger, Ph. D., (1882-1945) vanwege zijn experimentele vaardigheid, en begiftigde een nieuwe positie in de wiskundige natuurkunde om een volledig natuurkunde programma af te ronden. Rutherford betrad het centrum van de natuurkundewereld. Onderzoekers kwamen tientallen keren naar hem toe.
Rutherford kwam met veel onderzoeksvragen in gedachten. Hij was nog niet klaar met de puzzels van de vervalfamilies van thorium, radium, enz. maar hij gaf veel van dit werk door aan Boltwood, Hahn en Soddy. Boltwood en Hahn werkten beiden samen met Rutherford in Manchester, Boltwood in 1909-1910 en Hahn in 1907-1908., Rutherford richtte zijn aandacht geleidelijk veel meer op de α (Alfa), β (beta), en γ (gamma) stralen zelf en op wat ze zouden kunnen onthullen over het atoom. Dat wil zeggen, Hij liet radio-chemie over aan anderen en wendde zich tot natuurkunde.
 Rutherford verzamelde altijd een groep slimme jonge onderzoekers om hem heen. Op deze groepsfoto uit 1910 staan Ernest Marsden en Hans Geiger. Vooraan en Midden zijn professoren Schuster en Rutherford, en gecentreerd in de achterkant is William Kay, de getalenteerde en behulpzame laboratorium steward. Credit: J. B. Birks, ed.,, Rutherford at Manchester (London: Heywood & Co.(1962), tegenover blz. 38. Rutherford ‘ s vroege team in Manchester bestond uit Geiger en William Kay( 1879-1961), junior laboratoriumassistent sinds 1894. Rutherford promoveerde Kay tot laboratorium steward in 1908, om laboratoriumapparatuur te beheren en hem te helpen bij zijn onderzoek. In 1957 dacht Kay terug aan zijn jeugd met Rutherford in een interview. De taal is vreemd, maar de beschrijving komt zo dicht mogelijk bij Rutherford ‘ s aanpak., De vraagsteller was Samuel Devons (1914-2006), een van Rutherford ‘ s laatste studenten in de jaren 1930.
Rutherford verzamelde altijd een groep slimme jonge onderzoekers om hem heen. Op deze groepsfoto uit 1910 staan Ernest Marsden en Hans Geiger. Vooraan en Midden zijn professoren Schuster en Rutherford, en gecentreerd in de achterkant is William Kay, de getalenteerde en behulpzame laboratorium steward. Credit: J. B. Birks, ed.,, Rutherford at Manchester (London: Heywood & Co.(1962), tegenover blz. 38. Rutherford ‘ s vroege team in Manchester bestond uit Geiger en William Kay( 1879-1961), junior laboratoriumassistent sinds 1894. Rutherford promoveerde Kay tot laboratorium steward in 1908, om laboratoriumapparatuur te beheren en hem te helpen bij zijn onderzoek. In 1957 dacht Kay terug aan zijn jeugd met Rutherford in een interview. De taal is vreemd, maar de beschrijving komt zo dicht mogelijk bij Rutherford ‘ s aanpak., De vraagsteller was Samuel Devons (1914-2006), een van Rutherford ‘ s laatste studenten in de jaren 1930.
 Hans Geiger was Rutherford ‘ s belangrijkste partner in alpha-ray onderzoek van 1907 tot 1913. Samen ontwikkelden ze verschillende manieren om alfastralen te detecteren. Ze beweerden dat alfastralen dubbel geïoniseerde heliumkernen zijn. Certificeringsinstantie. 1908. Credit: AIP Emilio Segre visuele Archieven, Physics Today collectie.Rutherford en Hans Geiger werkten in 1907 en 1908 nauw samen aan de detectie en meting van α-deeltjes., Als ze α-deeltjes zouden gebruiken om het atoom te onderzoeken, moesten ze eerst meer weten over deze deeltjes en hun gedrag. Rutherford had geprobeerd en faalde bij McGill om α deeltjes te tellen.een jaar later slaagden hij en Geiger in Manchester in twee methoden om α-deeltjes te observeren. De eerste methode bestond uit splinters die door α-deeltjes op een dunne laag zinksulfide werden aangezogen. Zij observeerden deze door een microscoop en telden de scintillaties onder verschillende hoeken van verspreiding., Ze ontwikkelden ook een “elektrometer” die de passage van een individueel α-deeltje naar een groot publiek kon aantonen. Het instrument, dat evolueerde tot de” Geigerteller”, had een gedeeltelijk geëvacueerde metalen cilinder met een draad in het midden. Ze brachten een spanning tussen de cilinder en de draad hoog genoeg om te vonken. Door een dun mica-venster werden deeltjes toegelaten, waar deze deeltjes botsten met gassen, waardoor gasionen werden geproduceerd. Deze botsten vervolgens met andere moleculen en produceerden meer ionen, enzovoort., Elk α-deeltje produceerde een cascade van ionen, die de cilinder gedeeltelijk ontladen en de passage van een α-deeltje aangeven. Geiger en Rutherford publiceerden in 1908 en 1909 verschillende artikelen over deze methoden en het gebruik ervan.Rutherford schreef aan Henry Bumstead (1870-1920), een Amerikaanse natuurkundige, op 11 juli 1908: Geiger is een goed mens en werkt als een slaaf. Ik had nooit tijd kunnen vinden voor het zwoegen voordat we alles in goede stijl hadden. Uiteindelijk ging alles goed, maar de verstrooiing is de duivel. Onze buis werkte als een charme en we konden gemakkelijk een worp van 50 mm., voor elk deeltje. … Geiger is een demon aan het werk van het tellen van sprankelingen en kon met tussenpozen een hele nacht tellen zonder zijn gelijkmoedigheid te verstoren. Ik ben na twee minuten met pensioen gegaan. (Geciteerd in Eva, p. 180.hoewel Rutherford al in 1906 vermoedde dat α-deeltjes heliumatomen waren die van hun elektronen waren ontdaan, eiste hij een hoge mate van bewijs. Eén soort experiment was niet genoeg. Eén soort detector was niet genoeg. Hij wilde meer bewijs., Rutherford wilde hiervoor “grote spanningen” en grote elektromagneten om α-deeltjes af te leiden, maar deze methode was nog niet rijp. Lab steward William Kay herinnerde in het geciteerde mondelinge geschiedenisinterview dat Rutherford in 1908 erop stond dat sterke elektrische en magnetische velden nodig waren om de lading en massa van de α-En β-deeltjes directer te meten:
Hans Geiger was Rutherford ‘ s belangrijkste partner in alpha-ray onderzoek van 1907 tot 1913. Samen ontwikkelden ze verschillende manieren om alfastralen te detecteren. Ze beweerden dat alfastralen dubbel geïoniseerde heliumkernen zijn. Certificeringsinstantie. 1908. Credit: AIP Emilio Segre visuele Archieven, Physics Today collectie.Rutherford en Hans Geiger werkten in 1907 en 1908 nauw samen aan de detectie en meting van α-deeltjes., Als ze α-deeltjes zouden gebruiken om het atoom te onderzoeken, moesten ze eerst meer weten over deze deeltjes en hun gedrag. Rutherford had geprobeerd en faalde bij McGill om α deeltjes te tellen.een jaar later slaagden hij en Geiger in Manchester in twee methoden om α-deeltjes te observeren. De eerste methode bestond uit splinters die door α-deeltjes op een dunne laag zinksulfide werden aangezogen. Zij observeerden deze door een microscoop en telden de scintillaties onder verschillende hoeken van verspreiding., Ze ontwikkelden ook een “elektrometer” die de passage van een individueel α-deeltje naar een groot publiek kon aantonen. Het instrument, dat evolueerde tot de” Geigerteller”, had een gedeeltelijk geëvacueerde metalen cilinder met een draad in het midden. Ze brachten een spanning tussen de cilinder en de draad hoog genoeg om te vonken. Door een dun mica-venster werden deeltjes toegelaten, waar deze deeltjes botsten met gassen, waardoor gasionen werden geproduceerd. Deze botsten vervolgens met andere moleculen en produceerden meer ionen, enzovoort., Elk α-deeltje produceerde een cascade van ionen, die de cilinder gedeeltelijk ontladen en de passage van een α-deeltje aangeven. Geiger en Rutherford publiceerden in 1908 en 1909 verschillende artikelen over deze methoden en het gebruik ervan.Rutherford schreef aan Henry Bumstead (1870-1920), een Amerikaanse natuurkundige, op 11 juli 1908: Geiger is een goed mens en werkt als een slaaf. Ik had nooit tijd kunnen vinden voor het zwoegen voordat we alles in goede stijl hadden. Uiteindelijk ging alles goed, maar de verstrooiing is de duivel. Onze buis werkte als een charme en we konden gemakkelijk een worp van 50 mm., voor elk deeltje. … Geiger is een demon aan het werk van het tellen van sprankelingen en kon met tussenpozen een hele nacht tellen zonder zijn gelijkmoedigheid te verstoren. Ik ben na twee minuten met pensioen gegaan. (Geciteerd in Eva, p. 180.hoewel Rutherford al in 1906 vermoedde dat α-deeltjes heliumatomen waren die van hun elektronen waren ontdaan, eiste hij een hoge mate van bewijs. Eén soort experiment was niet genoeg. Eén soort detector was niet genoeg. Hij wilde meer bewijs., Rutherford wilde hiervoor “grote spanningen” en grote elektromagneten om α-deeltjes af te leiden, maar deze methode was nog niet rijp. Lab steward William Kay herinnerde in het geciteerde mondelinge geschiedenisinterview dat Rutherford in 1908 erop stond dat sterke elektrische en magnetische velden nodig waren om de lading en massa van de α-En β-deeltjes directer te meten:
Kay zei dat Rutherford een grote, watergekoelde magneet wilde, maar dat hij “hem liet vallen als een hete taart” toen hij de kosten ervan leerde. Dus hij had een nieuwe aanvalslijn nodig. De nieuwe lijn was heel eenvoudig, een chemische procedure gemengd met natuurkunde., Voor dit werk rekruteerde Rutherford Thomas Royds (1884-1955), die in 1906 zijn Physics Honours degree had behaald. Zij verzamelden a deeltjes in een gesloten glazen buis, comprimeerden ze, en lieten een elektrische vonk door. Ze bestudeerden het uitgestraalde licht in een spectroscoop en vonden het identiek aan het spectrum van helium. Binnen een paar maanden kreeg Rutherford de Nobelprijs voor de Scheikunde, ” voor zijn onderzoek naar de desintegratie van de elementen en de chemie van radioactieve stoffen., Rutherford en Royds hadden de identiteit en primaire eigenschappen van α-deeltjes vastgesteld. Rutherford gebruikte ze om het atoom te onderzoeken.in de herfst van 1908 begon een belangrijke reeks onderzoeken. Geiger had bundels van A-deeltjes door goud en andere metaalfolies geleid, waarbij met behulp van de nieuwe detectietechnieken werd gemeten hoeveel deze bundels door de atomen in de folies werden verspreid. Geiger dacht dat Ernest Marsden (1889-1970), een 19-jarige student in Honours Physics, klaar was om te helpen bij deze experimenten en stelde het voor aan Rutherford., Omdat Rutherford vaak duwde derdejaars studenten in onderzoek, zeggen dat dit was de beste manier om te leren over natuurkunde, hij gemakkelijk mee eens.
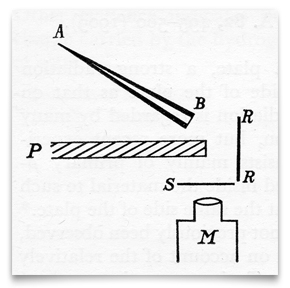 deze schets, uit het artikel van Geiger en Marsden uit 1909, toont een conische glazen buis vol” radium emanatie ” (radon), afgesloten bij B met een dun mica-Paneel. Dit was hun bron van Alfa (α) deeltjes. S was een zink-sulfide scherm, dat sprankelde wanneer getroffen door een α-deeltje. P was een loodscherm, waardoor alle α-deeltjes niet rechtstreeks naar het zinksulfidescherm konden reizen., RR was een folie (of folies) van verschillende metalen (waaronder goud) die invallende a-deeltjes diffuus reflecteerde. Geiger and Marsden observed the resulterende scintillations through an observing microscope, M. Credit: H. Geiger and E. Marsden, “On a Diffuse Reflection of the α-Particles,” Proceedings of the Royal Society,1909, 82:495-500.Geiger en Marsden begonnen met small-angle dispersie en probeerden verschillende diktes van Folies, waarbij ze wiskundige relaties zochten tussen dispersie en dikte van folie of het aantal doorgelaten atomen., Marsden herinnerde zich later dat Rutherford tegen hem zei te midden van deze experimenten: “kijk of je een effect kunt krijgen van alfa-deeltjes direct gereflecteerd van een metalen oppervlak.”(Gerapporteerd door Marsden in Birks, 1962, p. 8). Marsden betwijfelde of Rutherford terug de verspreiding van α-deeltjes verwachtte, maar zoals Marsden schreef was het een van die’ ingevingen ‘dat misschien enig effect kon worden waargenomen, en dat in ieder geval dat naburige grondgebied van deze Tom Tiddler’ s grond zou kunnen worden verkend door verkenning., Rutherford was altijd bereid om het onverwachte te ontmoeten en te exploiteren, waar gunstig, maar hij wist ook wanneer te stoppen op dergelijke excursies. (Birks, 1962, p. 8)
deze schets, uit het artikel van Geiger en Marsden uit 1909, toont een conische glazen buis vol” radium emanatie ” (radon), afgesloten bij B met een dun mica-Paneel. Dit was hun bron van Alfa (α) deeltjes. S was een zink-sulfide scherm, dat sprankelde wanneer getroffen door een α-deeltje. P was een loodscherm, waardoor alle α-deeltjes niet rechtstreeks naar het zinksulfidescherm konden reizen., RR was een folie (of folies) van verschillende metalen (waaronder goud) die invallende a-deeltjes diffuus reflecteerde. Geiger and Marsden observed the resulterende scintillations through an observing microscope, M. Credit: H. Geiger and E. Marsden, “On a Diffuse Reflection of the α-Particles,” Proceedings of the Royal Society,1909, 82:495-500.Geiger en Marsden begonnen met small-angle dispersie en probeerden verschillende diktes van Folies, waarbij ze wiskundige relaties zochten tussen dispersie en dikte van folie of het aantal doorgelaten atomen., Marsden herinnerde zich later dat Rutherford tegen hem zei te midden van deze experimenten: “kijk of je een effect kunt krijgen van alfa-deeltjes direct gereflecteerd van een metalen oppervlak.”(Gerapporteerd door Marsden in Birks, 1962, p. 8). Marsden betwijfelde of Rutherford terug de verspreiding van α-deeltjes verwachtte, maar zoals Marsden schreef was het een van die’ ingevingen ‘dat misschien enig effect kon worden waargenomen, en dat in ieder geval dat naburige grondgebied van deze Tom Tiddler’ s grond zou kunnen worden verkend door verkenning., Rutherford was altijd bereid om het onverwachte te ontmoeten en te exploiteren, waar gunstig, maar hij wist ook wanneer te stoppen op dergelijke excursies. (Birks, 1962, p. 8)
Dit was Rutherford ‘ s speelse aanpak in actie. Zijn studenten en anderen probeerden zijn ideeën uit, waarvan vele doodlopend waren. Dit idee om te zoeken naar terugstrooiing van α-deeltjes heeft echter zijn vruchten afgeworpen., Rutherford schreef: het Experiment, geleid door de gedisciplineerde verbeelding van een individu of, nog beter, van een groep individuen met een gevarieerde mentale kijk, is in staat om resultaten te bereiken die de verbeelding alleen van de grootste filosoof ver overstijgen. (Geciteerd in Eve, 1939, Frontmatter)
enige tijd later in 1908 of 1909, zei Marsden, hij rapporteerde zijn resultaten aan Rutherford. Rutherford herinnerde zich dit een beetje anders:
Ik herinner me …later kwam Geiger in grote opwinding naar me toe en zei: ‘We hebben een deel van de α-deeltjes achterwaarts kunnen krijgen…,’Het was de meest ongelooflijke gebeurtenis die me ooit is overkomen in mijn leven. Het was bijna ongelooflijk alsof je een 15-inch omhulsel afvuurde op een stuk zijdepapier en het kwam terug en raakte je. (Rutherford, 1938, p. 68)
menselijk geheugen is feilbaar. Of Marsden of Geiger het Rutherford vertelde, het effect was hetzelfde. Rutherford zei dat ze een publicatie uit dit onderzoek moeten voorbereiden, die ze in mei 1909 hebben ingediend. Bovendien, dit begon Rutherford denken naar wat uiteindelijk, bijna twee jaar later, publiceerde hij als een theorie van het atoom.,
Wat deed Rutherford voor de rest van 1909 en heel 1910? Voor een ding, zijn goede vriend Boltwood was in Manchester voor het academisch jaar werken met Rutherford aan radioactief verval producten van radium. Hij besprak en sprak ook over eerdere ideeën over atomaire structuur. Het belangrijkste was dat hij het fenomeen van de verstrooiing van α-deeltjes systematisch uit elkaar nam en elk stuk testte. Rutherford had niet zijn gedurfde idee — het nucleaire atoom — onmiddellijk, maar hij kwam tot het geleidelijk door het probleem van vele kanten te overwegen.,in de herfst van 1910 bracht hij Marsden terug naar Manchester om zijn ideeën met Geiger grondig te testen. Zij hebben de emissiepercentages en het bereik van A-deeltjes door radioactieve bronnen opnieuw vastgesteld en hun statistische analyses opnieuw onderzocht. Rutherford probeerde verstrooiingsresultaten te verzoenen met verschillende atomaire modellen, in het bijzonder die van J. J. Thomson, waarin de positieve elektriciteit werd beschouwd als gelijkmatig verspreid over de hele bol van het atoom.
 een pagina van Rutherford ‘ s vroege, ongedateerde (1910 of 1911), ruwe noten., De eerste paar regels lezen: “theorie van de structuur van het atoom. Stel dat het atoom bestaat uit + lading ne in het centrum & van – lading als elektron verdeeld over de bol van straal r.” vervolgens ruimde hij ideeën uit over de berekening van de kracht van afbuiging op een geladen deeltje dat dicht bij dit geladen centrum passeert. Credit: J. B. Birks, ed., Rutherford at Manchester (London: Heywood & Co.(1962), blz. 70.in de winter van 1910-1911 werkte Rutherford het basisidee uit van een atoom met een geladen centrum.,”Zoals Geiger en Marsden in hun artikel uit 1909 opmerkten:
een pagina van Rutherford ‘ s vroege, ongedateerde (1910 of 1911), ruwe noten., De eerste paar regels lezen: “theorie van de structuur van het atoom. Stel dat het atoom bestaat uit + lading ne in het centrum & van – lading als elektron verdeeld over de bol van straal r.” vervolgens ruimde hij ideeën uit over de berekening van de kracht van afbuiging op een geladen deeltje dat dicht bij dit geladen centrum passeert. Credit: J. B. Birks, ed., Rutherford at Manchester (London: Heywood & Co.(1962), blz. 70.in de winter van 1910-1911 werkte Rutherford het basisidee uit van een atoom met een geladen centrum.,”Zoals Geiger en Marsden in hun artikel uit 1909 opmerkten:
Als rekening wordt gehouden met de hoge snelheid en massa van het α-deeltje, lijkt het verrassend dat sommige van de α-deeltjes, zoals het experiment aantoont, binnen een laag van 6 x 10-5 cm kunnen worden gedraaid. van goud door een hoek van 90°, en nog meer. Om een soortgelijk effect door een magnetisch veld te veroorzaken, zou het enorme veld van 109 absolute eenheden nodig zijn. (Birks, blz., 179)
Rutherford concludeerde in zijn artikel van mei 1911 dat een dergelijke opmerkelijke afwijking in het pad van een massief geladen deeltje alleen kon worden bereikt als het grootste deel van de massa van bijvoorbeeld een goudatoom en het grootste deel van de lading geconcentreerd waren in een zeer klein centraal lichaam. Opmerking: op dit punt in 1911, Rutherford noemde dit niet een ” nucleus.”
Je moet Flash Player geïnstalleerd hebben om naar deze audio clip te luisteren.,de eerste publieke aankondiging van de nucleaire theorie door Rutherford werd gedaan tijdens een bijeenkomst van de Manchester Literary and Philosophical Society, en hij nodigde ons jonge jongens uit om naar de bijeenkomst te gaan. Hij zei dat hij interessante dingen te zeggen had en hij dacht dat we ze graag wilden horen. We wisten toen niet waar het over ging. De oudere mensen in het laboratorium deden dat, natuurlijk wisten Geiger en Marsden dat omdat ze de experimenten al deden. In feite, tenzij ze hadden gedaan sommige die voldoende waren om beslissend te zijn, Rutherford nooit vermeld in het openbaar., Darwin wist het natuurlijk al veel eerder. Maar dat moet begin 1911 zijn geweest, en we gingen naar de vergadering en hij vertelde het ons. Hij zei toen dat er experimenteel bewijs was verkregen door Geiger en Marsden. Hij heeft, voor zover ik mij herinner, niet meer gezegd over de resultaten dan dat ze zeer beslissend waren. En, zoals ik al eerder zei, hij zou nooit zo ‘ n publieke aankondiging hebben gedaan als hij geen goed bewijs had gehad., En dat is een van de kenmerken die door al Rutherford ‘ s werk loopt, in het bijzonder al zijn werk tot het einde van de Manchester-periode. Als je kijkt naar een aantal van zijn papieren in de vroege dagen — Ik noem McGill de vroege dagen — hij was er vrij van overtuigd dat de alfa-deeltjes atomen van helium waren, maar hij heeft dat nooit gezegd in die woorden. Hij zei altijd dat het ofwel heliumatomen of waterstofmoleculen waren, of misschien heeft hij iets anders van dat gewicht gezegd., Het was karakteristiek voor hem dat hij nooit zou zeggen dat iets zo was, tenzij hij experimenteel bewijs had dat hem echt tevreden stelde.in feite was Rutherford uiterst voorzichtig in het trekken van conclusies over deze centrale lading: “een eenvoudige berekening toont aan dat het atoom een zetel van een intens elektrisch veld moet zijn om zo’ n grote deflexie bij een enkele ontmoeting te veroorzaken.”(Birks, p. 183). Hij werkte snel en grofweg uit dat verschillende kwantitatieve relaties waar zouden moeten zijn als deze basistheorie juist was., Ten eerste moet het aantal a-deeltjes dat door een bepaalde hoek wordt verspreid, evenredig zijn met de dikte van de folie. Ten tweede moet dat getal evenredig zijn met het kwadraat van de nucleaire lading. Ten slotte moet het omgekeerd evenredig zijn met het vierde vermogen van de snelheid van het α-deeltje. Deze drie ideeën legde het experimentele programma van Geiger en Marsden voor het volgende jaar.
u moet Flash Player geïnstalleerd hebben om naar deze audio clip te luisteren.,
Rutherford ‘ s interesse was toen bijna volledig in het onderzoek. Hij had weinig les gegeven in McGill. Hij was professor. Ik neem aan dat hij een aantal lezingen gaf, maar het zou heel weinig zijn geweest. Zijn interesse lag natuurlijk aan de onderzoekszijde. Hij gaf een aantal lezingen, maar elementaire lezingen, iets wat je zou verwachten dat een man zou weten voordat hij naar de universiteit kwam. Zij waren de lezingen voor de ingenieurs. Ze waren een ruige bende en Rutherford kon ze onder controle houden., Er was misschien maar één andere man in de afdeling die het had kunnen doen ,en hij (Rutherford?) genoten van hen omdat hij in staat was om hen te tonen de zeer interessante experimenten die men kan uitvoeren in elementaire cursussen.
Er is mij vaak gezegd dat Rutherford een slechte docent was. Ik heb nog nooit zulke onzin gehoord. Het is waar dat hij soms een beetje saai, een beetje verward zou zijn, maar dat was slechts bij zeer zeldzame gelegenheden. Er waren andere gelegenheden dat hij echt heel stimulerend was. Er was een enorm enthousiasme over hem.,
Rutherford hield rekening met de mogelijkheid dat het geladen centrum negatief is. Dat klinkt vreemd vandaag, dus wat maakte het redelijk? Ten eerste, het was niet heel anders dan Thomson ‘ s model. Ten tweede, omdat Rutherford wist dat α deeltjes een dubbele + lading dragen, dacht hij dat dit zou kunnen werken zoals de zon dat doet op een komeet die er dichtbij komt. Het katapulteerde het α-deeltje rond en terug naar zijn bron. Hij beschouwde ook een bijna vergeten model, voorgesteld door de Japanse natuurkundige Hantaro Nagaoka (1865-1950) — het saturnische model., Nagaoka en Rutherford waren in 1910 en 1911 in contact en Rutherford noemde Nagaoka ’s model van” een centrale aantrekkende massa omgeven door ringen van roterende elektronen” (Birks, p. 203). Het eindresultaat in deze kritische Rutherford paper was echter Rutherford ‘ s aankondiging dat of het atoom een schijf of een bol was, en of de centrale lading positief of negatief was, de berekeningen niet zou beïnvloeden. Rutherford was altijd voorzichtig om niet meer te claimen dan zijn resultaten konden ondersteunen.,
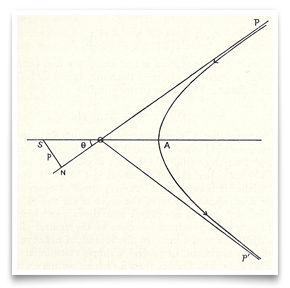 in Rutherford ‘ s nu beroemde artikel van mei 1911 over de verstrooiing van alfa-deeltjes door goudfolie, nam hij deze schets van het hyperbolische pad van een deeltje op. Credit: E. Rutherford, “The Scattering of α and β Particles by Matter and the Structure of Matter,” Philosophical Magazine, 1911, 21: 669-688.Rutherford zag mogelijke tests van de aard van de centrale lading. De absorptie van β-deeltjes, zei hij, zou anders moeten zijn met een negatief centrum versus een positief centrum., Een positief centrum zou de grote snelheid verklaren die α deeltjes bereiken tijdens de emissie van radioactieve elementen. Maar dit waren slechts hints.
in Rutherford ‘ s nu beroemde artikel van mei 1911 over de verstrooiing van alfa-deeltjes door goudfolie, nam hij deze schets van het hyperbolische pad van een deeltje op. Credit: E. Rutherford, “The Scattering of α and β Particles by Matter and the Structure of Matter,” Philosophical Magazine, 1911, 21: 669-688.Rutherford zag mogelijke tests van de aard van de centrale lading. De absorptie van β-deeltjes, zei hij, zou anders moeten zijn met een negatief centrum versus een positief centrum., Een positief centrum zou de grote snelheid verklaren die α deeltjes bereiken tijdens de emissie van radioactieve elementen. Maar dit waren slechts hints.
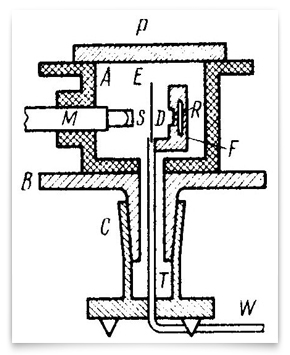 dit schema geeft de verfijnde experimenten van 1912-13 weer, uitgevoerd door Geiger en Marsden. R was de bron van alfadeeltjes, E was de goudfolie, en M was de microscoop draaibaar rond een verticale as gecentreerd op de goudfolie. Alfa-deeltjes van de bron gingen door het diafragma D, werden verspreid door de folie, en werden waargenomen als splinters op het scherm S., Geiger en Marsden waargenomen de hoeken van verstrooide deeltjes door het draaien van de microscoop-scherm assemblage. Credit: H. Geiger and E. Marsden, “the Laws of Deflexion of α Particles through Large Angles,” Philosophical Magazine, 1913, 25: 604-623.Geiger en Marsden werkten inderdaad systematisch door de testbare implicaties van Rutherford ‘ s centrale ladingshypothese. De eerste grote publicatie van hun resultaten was in het Duits in de Sitzungberichte der Wiener Akademie der Wissenschaften in 1912., Deze 30 pagina ‘ s tellende versie werd in 1913 gevolgd door een Engelse versie in het filosofisch tijdschrift: “The Laws of Deflexion of α Particles through Large Angles”. Kleine verschillen tussen de twee leidden ertoe dat een historicus suggereerde dat Rutherford in augustus 1912 (Trenn, 1974) voor een positief geladen centrum koos. Rutherford ’s andere teamleden, met name Charles Galton Darwin (1887-1962), H. G. J. Moseley (1887-1915), en Niels Bohr (1885-1962) speelden een belangrijke rol in de uiteindelijke oprichting van Rutherford’ s nucleaire atoom.,
dit schema geeft de verfijnde experimenten van 1912-13 weer, uitgevoerd door Geiger en Marsden. R was de bron van alfadeeltjes, E was de goudfolie, en M was de microscoop draaibaar rond een verticale as gecentreerd op de goudfolie. Alfa-deeltjes van de bron gingen door het diafragma D, werden verspreid door de folie, en werden waargenomen als splinters op het scherm S., Geiger en Marsden waargenomen de hoeken van verstrooide deeltjes door het draaien van de microscoop-scherm assemblage. Credit: H. Geiger and E. Marsden, “the Laws of Deflexion of α Particles through Large Angles,” Philosophical Magazine, 1913, 25: 604-623.Geiger en Marsden werkten inderdaad systematisch door de testbare implicaties van Rutherford ‘ s centrale ladingshypothese. De eerste grote publicatie van hun resultaten was in het Duits in de Sitzungberichte der Wiener Akademie der Wissenschaften in 1912., Deze 30 pagina ‘ s tellende versie werd in 1913 gevolgd door een Engelse versie in het filosofisch tijdschrift: “The Laws of Deflexion of α Particles through Large Angles”. Kleine verschillen tussen de twee leidden ertoe dat een historicus suggereerde dat Rutherford in augustus 1912 (Trenn, 1974) voor een positief geladen centrum koos. Rutherford ’s andere teamleden, met name Charles Galton Darwin (1887-1962), H. G. J. Moseley (1887-1915), en Niels Bohr (1885-1962) speelden een belangrijke rol in de uiteindelijke oprichting van Rutherford’ s nucleaire atoom.,
 The young Henry G. J. Moseley, in the Balliol-Trinity Laboratory, Oxford, ca. 1910. Later dat jaar begon Moseley onderzoek in Rutherford ‘ s Manchester lab. Zijn briljante carrière werd ingekort in de strijd in de Eerste Wereldoorlog I. Credit: University Of Oxford, Museum of the History of Science, courtesy AIP Emilio Segrè Visual Archives, Physics Today Collection.de ‘Grote Oorlog’ verstoorde het werk in Rutherford ‘ s Manchester department. Bohr keerde terug naar Denemarken. Marsden accepteerde een hoogleraarschap in Nieuw-Zeeland. Moseley stierf in de Slag bij Gallipoli., James Chadwick (1891-1974), die samenwerkte met Geiger aan de Technische Universiteit van Berlijn toen de oorlog uitbrak, bracht enkele jaren door in het kamp Ruhleben voor krijgsgevangenen. Andere studenten gingen ook naar de oorlog, en Rutherford besteedde veel energie aan het mobiliseren van de wetenschap voor de oorlogsinspanning en specifiek aan anti-onderzeeër technieken.
The young Henry G. J. Moseley, in the Balliol-Trinity Laboratory, Oxford, ca. 1910. Later dat jaar begon Moseley onderzoek in Rutherford ‘ s Manchester lab. Zijn briljante carrière werd ingekort in de strijd in de Eerste Wereldoorlog I. Credit: University Of Oxford, Museum of the History of Science, courtesy AIP Emilio Segrè Visual Archives, Physics Today Collection.de ‘Grote Oorlog’ verstoorde het werk in Rutherford ‘ s Manchester department. Bohr keerde terug naar Denemarken. Marsden accepteerde een hoogleraarschap in Nieuw-Zeeland. Moseley stierf in de Slag bij Gallipoli., James Chadwick (1891-1974), die samenwerkte met Geiger aan de Technische Universiteit van Berlijn toen de oorlog uitbrak, bracht enkele jaren door in het kamp Ruhleben voor krijgsgevangenen. Andere studenten gingen ook naar de oorlog, en Rutherford besteedde veel energie aan het mobiliseren van de wetenschap voor de oorlogsinspanning en specifiek aan anti-onderzeeër technieken.
 Niels Bohr werkte voor het eerst samen met Rutherford in Manchester in 1912. Deze foto toont de jonge Niels en Margrethe Bohr, ca., 1914, toen Bohr Charles Galton Darwin opvolgde als de Schuster-lezer in de wiskundige natuurkunde in Manchester. Credit: AIP Emilio Segre Visual Archives, Margrethe Bohr Collection.tegen deze achtergrond begonnen Rutherford en zijn Lab steward William Kay in 1917 de passage van α-deeltjes door waterstof, stikstof en andere gassen te onderzoeken. Toen de Grote Oorlog eindigde, hielp Ernest Marsden kort met de vervelende scintillatie-observaties die aanwijzingen gaven voor de aard van de kern. Rutherford rapporteerde de voorlopige resultaten van deze uitgebreide experimenten in 1919., Rutherford plaatste een bron van radium C (bismut-214) in een afsluitbare messing container, zodat de positie van de bron kan worden veranderd en zodat verschillende gassen kunnen worden ingevoerd of een vacuüm geproduceerd, zoals gewenst. De α deeltjes doorkruisten de binnenkant van de container en gingen door een spleet, bedekt met een zilveren plaat of ander materiaal, en raakten een zinksulfide scherm, waar een scintillatie werd waargenomen in een donkere kamer. Bij het inbrengen van waterstofgas in het reservoir en het opvangen van de α-deeltjes voordat zij het scherm raken, werden nog steeds sprankelingen waargenomen., Rutherford stelde dat als De α-deeltjes het waterstofgas doorkruisten, ze af en toe botsten met waterstofkernen. Zoals Rutherford schreef, produceerde dit “snelle waterstofatomen” die meestal naar voren werden geprojecteerd in de richting van de oorspronkelijke beweging van de α-deeltjes.
Niels Bohr werkte voor het eerst samen met Rutherford in Manchester in 1912. Deze foto toont de jonge Niels en Margrethe Bohr, ca., 1914, toen Bohr Charles Galton Darwin opvolgde als de Schuster-lezer in de wiskundige natuurkunde in Manchester. Credit: AIP Emilio Segre Visual Archives, Margrethe Bohr Collection.tegen deze achtergrond begonnen Rutherford en zijn Lab steward William Kay in 1917 de passage van α-deeltjes door waterstof, stikstof en andere gassen te onderzoeken. Toen de Grote Oorlog eindigde, hielp Ernest Marsden kort met de vervelende scintillatie-observaties die aanwijzingen gaven voor de aard van de kern. Rutherford rapporteerde de voorlopige resultaten van deze uitgebreide experimenten in 1919., Rutherford plaatste een bron van radium C (bismut-214) in een afsluitbare messing container, zodat de positie van de bron kan worden veranderd en zodat verschillende gassen kunnen worden ingevoerd of een vacuüm geproduceerd, zoals gewenst. De α deeltjes doorkruisten de binnenkant van de container en gingen door een spleet, bedekt met een zilveren plaat of ander materiaal, en raakten een zinksulfide scherm, waar een scintillatie werd waargenomen in een donkere kamer. Bij het inbrengen van waterstofgas in het reservoir en het opvangen van de α-deeltjes voordat zij het scherm raken, werden nog steeds sprankelingen waargenomen., Rutherford stelde dat als De α-deeltjes het waterstofgas doorkruisten, ze af en toe botsten met waterstofkernen. Zoals Rutherford schreef, produceerde dit “snelle waterstofatomen” die meestal naar voren werden geprojecteerd in de richting van de oorspronkelijke beweging van de α-deeltjes.
Rutherford had tijdens deze experimenten een aantal subtiele vragen in gedachten, die voornamelijk betrekking hadden op de aard van de kern., Hij vroeg zijn collega Darwin om deze botsingen te analyseren op basis van een’ eenvoudige theorie ‘ van elastische botsingen tussen puntkernen die worden afgestoten volgens een omgekeerde kwadratenwet, De α deeltjes die een lading dragen van 2 keer die van een elektron (en van tegenovergesteld teken) en de waterstofkernen 1 keer. Darwin ontdekte dat alle A-deeltjes die binnen 2, 4×10-13 cm naderen, een ‘snel waterstofatoom’ zouden produceren.’Deze eenvoudige theorie voorspelde echter veel minder versnelde waterstofatomen dan in de experimenten werd waargenomen.,
Rutherford verwierp verklaringen voor deze variantie op basis van verschillende ladingen op de deeltjes of andere wetten dan inverse kwadratenwetten. Integendeel, hij concludeerde dat Voor afstanden in de Orde van de diameter van het elektron, ‘de structuur van de heliumkern niet langer kan worden beschouwd als een punt…’. Hij stelde dat de heliumkern (α-deeltje) een complexe structuur heeft van vier waterstofkernen plus twee negatief geladen elektronen. (We zouden zeggen dat het bestaat uit twee protonen., Rutherford concludeerde dat vervorming van complexe kernen tijdens botsingen een waarschijnlijker verklaring was, de variatie van de krachten tussen de kernen varieert op een complexe manier bij een nauwe benadering.rekening houdend met de intense krachten die bij dergelijke botsingen in het spel zijn, zou het niet verwonderlijk zijn als de heliumkern zou breken. Er is geen bewijs van een dergelijke desintegratie…gevonden, wat erop wijst dat de heliumkern een zeer stabiele structuur moet zijn.,we moeten niet vergeten dat Rutherford de structuur van de kern niet direct kon waarnemen, dus zijn conclusies waren voorlopig. Niettemin hield hij zich openlijk bezig met de mogelijkheden van een complexe kern, die in staat is tot vervorming en zelfs tot desintegratie. Deze gedachten vormden deze intense periode van experimentele onderzoeken.