elektronenconfiguratie
de elektronen in een atoom vullen zijn atomaire orbitalen op volgens het Aufbau-Principe; ” Aufbau “betekent in het Duits “opbouwen”.”Het Aufbau-principe, dat het Pauli-uitsluitingsprincipe en de regel van Hund bevat, schrijft enkele eenvoudige regels voor om de volgorde te bepalen waarin elektronen atomaire orbitalen vullen:
- elektronen vullen altijd eerst orbitalen met lagere energie. 1s is gevuld voor 2s, en 2s voor 2p., het Pauli-uitsluitingsprincipe stelt dat geen twee elektronen binnen een bepaald atoom identieke kwantumgetallen kunnen hebben. In functie betekent dit principe dat als twee elektronen dezelfde baan hebben, ze een tegengestelde spin moeten hebben.
- Hund ‘ s regel stelt dat wanneer een elektron zich aansluit bij een atoom en moet kiezen tussen twee of meer orbitalen van dezelfde energie, het elektron de voorkeur zal geven aan een lege orbitaal in plaats van een al bezet., Naarmate meer elektronen aan het atoom worden toegevoegd, hebben deze elektronen de neiging om orbitalen van dezelfde energie half te vullen voordat ze worden gekoppeld aan bestaande elektronen om orbitalen te vullen.
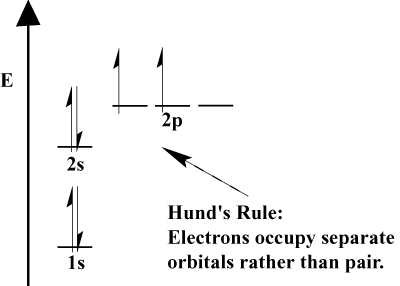
valentie-en valentie-elektronen
de buitenste orbitale schil van een atoom wordt zijn valentieschelp genoemd, en de elektronen in de valentieschelp zijn valentie-elektronen. Valentie-elektronen zijn de hoogste energie-elektronen in een atoom en zijn daarom het meest reactief. Terwijl innerlijke elektronen (die niet in de valentieschil) meestal niet deelnemen aan chemische binding en reacties, kunnen valentie-elektronen worden gewonnen, verloren, of gedeeld om chemische bindingen te vormen., Om deze reden hebben elementen met hetzelfde aantal valentie-elektronen de neiging om vergelijkbare chemische eigenschappen te hebben, omdat ze de neiging hebben om valentie-elektronen op dezelfde manier te winnen, te verliezen of te delen. Het Periodiek Systeem is ontworpen met deze functie in het achterhoofd. Elk element heeft een aantal valentie-elektronen dat gelijk is aan zijn groepsnummer op het Periodiek Systeem.
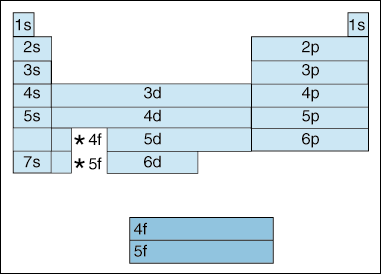
deze tabel illustreert een aantal interessante en complicerende kenmerken van elektronenconfiguratie.,
eerst vindt er een verschuiving plaats naarmate elektronen hoger in energie worden. Tot nu toe hebben we gezegd dat naarmate het principe van het kwantumgetal toeneemt, ook het energieniveau van de orbitaal toeneemt. En, zoals we hierboven in het Aufbau principe hebben gezegd, vullen elektronen lagere energie orbitalen voordat ze hogere energie orbitalen vullen. Het diagram hierboven laat echter duidelijk zien dat de 4S-orbitaal vóór de 3d-orbitaal is gevuld., Met andere woorden, als we eenmaal bij Principe quantumgetal 3 zijn, verduisteren de hoogste subschellen van de lagere kwantumgetallen in energie de laagste subschellen van de hogere kwantumgetallen: 3d is van hogere energie dan 4s.
ten tweede geeft het bovenstaande een methode aan om een element te beschrijven volgens zijn elektronenconfiguratie. Als je van links naar rechts over het periodiek systeem beweegt, toont het bovenstaande diagram de volgorde waarin orbitalen worden gevuld. Als we het bovenstaande diagram zouden splitsen in groepen in plaats van de blokken die we hebben, zou het laten zien hoe precies hoeveel elektronen elk element heeft., Bijvoorbeeld, het element waterstof, gelegen in de bovenste linkerhoek van het periodiek systeem, wordt beschreven als 1s1, waarbij de s beschrijft welke baan elektronen bevat en de 1 beschrijft hoeveel elektronen er in die baan wonen. Lithium, dat zich bevindt op het periodiek systeem net onder waterstof, zou worden beschreven als 1s22s1. De elektronenconfiguraties van de eerste tien elementen worden hieronder weergegeven (merk op dat de valentie-elektronen het elektron in de hoogste energie-schil zijn, niet alleen de elektronen in de hoogste energie-subschil).,

de octetregel
onze discussie over valentieelektronenconfiguraties leidt ons naar een van de hoofdbeginselen van chemische binding, de octetregel. De octetregel stelt dat atomen vooral stabiel worden wanneer hun valentieschelpen een volledige aanvulling van valentie-elektronen krijgen. Bijvoorbeeld, in bovenstaande, Helium (He) en Neon (Ne) hebben buitenste valentie schelpen die volledig zijn gevuld, dus geen van beide heeft de neiging om te winnen of te verliezen elektronen., Daarom bestaan Helium en Neon, twee van de zogenaamde edelgassen, in vrije atomaire vorm en vormen gewoonlijk geen chemische bindingen met andere atomen.
De meeste elementen hebben echter geen volledige buitenste schil en zijn te onstabiel om als vrije atomen te bestaan. In plaats daarvan proberen ze hun buitenste elektronenschillen te vullen door chemische bindingen met andere atomen te vormen en zo edelgasconfiguratie te bereiken. Een element zal de neiging hebben om de kortste weg te nemen naar het bereiken van edelgasconfiguratie, of dat nu betekent het verkrijgen of verliezen van een elektron., Bijvoorbeeld, natrium (Na), die een enkel elektron in zijn buitenste 3S orbitaal heeft, kan dat elektron verliezen om de elektronenconfiguratie van neon te bereiken. Chloor, met zeven valentie-elektronen, kan één elektron bereiken om de configuratie van argon te bereiken. Wanneer twee verschillende elementen dezelfde elektronenconfiguratie hebben, worden ze ISO-elektronisch genoemd.
diamagnetisme en paramagnetisme
de elektronenconfiguratie van een atoom heeft ook gevolgen voor zijn gedrag met betrekking tot magnetische velden. Dergelijk gedrag is afhankelijk van het aantal elektronen dat een atoom heeft die spin gekoppeld zijn., Onthoud dat de regel van Hund en het Pauli-uitsluitingsprincipe samen dicteren dat de orbitalen van een atoom half gevuld zullen zijn voordat ze volledig gevuld worden, en dat wanneer ze volledig gevuld zijn met twee elektronen, deze twee elektronen tegengestelde spins zullen hebben.
een atoom met al zijn orbitalen gevuld, en dus al zijn elektronen gecombineerd met een elektron met een tegengestelde spin, zal zeer weinig beïnvloed worden door magnetische velden. Dergelijke atomen worden diagmetic genoemd. Omgekeerd, hebben paramagnetische atomen niet al hun elektronen spin-gepaarde en worden beà nvloed door magnetische velden., Er zijn graden van paramagnetisme, omdat een atoom één ongepaarde elektron kan hebben, of het kan er vier hebben.