ijzeroxide, ook wel ijzertrihydraat of ijzer(III) oxide genoemd, is een anorganische verbinding die wordt vertegenwoordigd door de chemische formule Fe2O3 of Fe2H6O3 . Het is een van de belangrijkste oxiden van ijzer, de andere twee zijn ferrosoferric oxide (Fe3O4) en ferro oxide (FeO) respectievelijk . Het komt van nature voor als het mineraal hematiet .,
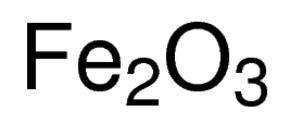
formule
gehydrateerd ijzeroxide
Het is een roodbruine gelatineachtige verbinding geproduceerd door toevoeging van alkali aan oplossingen die Fe(III) zouten bevatten. Het wordt ook waterhoudend ijzeroxide genoemd en kan chemisch als Fe2O3 worden voorgesteld.H2O of Fe (O)OH . Sommige gemeenschappelijke vormen van de gehydrateerde ijzeroxide omvatten rode lepidocrocite die extern in rusticles en oranje goethite voorkomt die op de binnenkant van rusticles voorkomt.,
hoe wordt ijzeroxide bereid
ijzeroxide wordt in het laboratorium gesynthetiseerd door elektrolyse van natriumbicarbonaatoplossing, die werkt als een inerte elektrolyt en een ijzeranode. De elektrolytische omzetting van ijzer in gehydrateerd ijzer (III) oxide wordt weergegeven als:
4Fe + 3O2 + 2H2O → 4 FeO(OH)
het aldus geproduceerde gehydrateerd ijzer (III) oxide ondergaat dehydratatie bij ongeveer 200 °C om ijzeroxide te vormen ., om ijzersulfaat (FeSO4), die verder geoxideerd tot ijzer (iii) sulfaat :
- FeS2 + 7O+ H2O → FeSO4 + H2SO4
- 2FeSO4 + H2SO4 + O → Fe2(SO4)3 + H2O
Aluminium vervangt Ijzer van Ijzer (iii) Oxide
Aluminium en ijzer (iii) oxide ondergaan een redox-reactie waarbij de metalen vervangt ijzer te vormen aluminium oxide:
Fe2O3 + 2Al → Al2O3 + 2Fe
Eigenschappen en Kenmerken van Ijzer (iii) Oxide
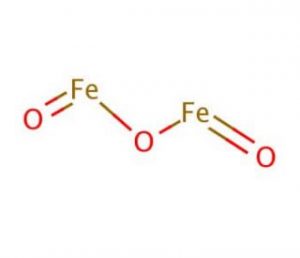
de Structuur van Ijzer (iii) Oxide
Toepassingen
- In de ijzer-industrie voor het produceren van staal en legeringen .,
- Ijzeroxidepoeder, ook wel jeweler ‘ s rouge genoemd, wordt gebruikt voor het polijsten van lenzen en metalen sieraden .
- zijn korrelvorm wordt gebruikt als filtermedium voor het verwijderen van fosfaten in zoutwateraquaria .
- als FDA-goedgekeurd Pigment Brown 6 en Pigment Red 101, voor gebruik in cosmetica .
- in biomedische toepassingen, omdat de nanodeeltjes niet-toxisch en biocompatibel zijn .
is het gevaarlijk
langdurige blootstelling aan de rook of het stof kan leiden tot pneumoconiose met koorts, rillingen, pijn, kortademigheid en hoesten ., Herhaald contact met de ogen kan het verkleuren en permanente ijzerkleuring veroorzaken .
- ijzer(III) oxide – Chemspider.com
- ijzeroxide rood – Pubchem.ncbi.nlm.hih.gov
- magnetiet (Fe3O4) – Pubchem.ncbi.nlm.nih.gov
- ijzeroxide – Pubchem.ncbi.nlm.nih.gov
- CHEBI: 50819-ijzeroxide – Ebi.ac.uk Ijzeroxidestof en-rook (als Fe) Cdc.gov
- Kinetica en mechanisme van de dehydratie van γ-FeOOH – Researchgate.net
- ijzer (III) Oxide – deeltjes Americanelements.com
- ijzeroxide-Chemicalbook.,com –
- Magnetische Eigenschappen van Materialen – Sigmaaldrich.com
- Ijzer(III) Oxide Chem.libretexts.org
- ijzeroxide (Fe2O3), Hydraat (Compound) – Pubchem.ncbi.nlm.nih.gov
- De oxidatie van ferrosulfaat aan ijzer (iii) sulfaat door middel van de lucht – Archive.org
- Gebruik van ijzeroxide – Zjunited.com
- Gevaarlijke Stof factsheet ijzeroxide – Nj.gov