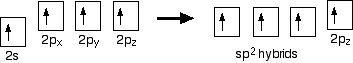een eenvoudige weergave van dubbele covalente bindingen
een dubbele covalente binding is waar twee paren elektronen tussen de atomen worden gedeeld in plaats van slechts één paar.
enkele eenvoudige moleculen met dubbele bindingen
Zuurstof, O2
twee zuurstofatomen kunnen beide stabiele structuren bereiken door twee paren elektronen te delen zoals in het diagram.
De dubbele binding wordt conventioneel weergegeven door twee lijnen die de atomen verbinden. Elke lijn vertegenwoordigt een paar gedeelde elektronen.,
kooldioxide, CO2
etheen, C2H4
etheen heeft een dubbele binding tussen de twee koolstofatomen.
een meer verfijnde weergave van de binding in etheen
Het is belangrijk om de binding in etheen gedetailleerder te onderzoeken omdat het een directe invloed heeft op de chemie ervan. Tenzij je enig begrip hebt van de ware aard van de dubbele binding, kun je niet echt begrijpen hoe etheen zich gedraagt.,
een orbitale weergave van de binding in etheen
etheen is opgebouwd uit waterstofatomen (1s1) en koolstofatomen (1s22s22px12py1).
promotie van een elektron
het koolstofatoom heeft niet genoeg ongepaarde elektronen om het vereiste aantal bindingen te vormen, dus moet het een van het 2S2-paar promoveren naar de lege 2PZ-Baan. Dit is precies hetzelfde als wanneer koolstof bindingen vormt – waar het dan ook mee verbonden is.
het koolstofatoom is nu in een opgewekte toestand.,
hybridisatie
in het geval van etheen is er een verschil met methaan omdat elke koolstof slechts drie andere atomen verbindt in plaats van vier. Wanneer de koolstofatomen hun buitenste orbitalen hybridiseren voordat ze bindingen vormen, hybridiseren ze deze keer slechts drie van de orbitalen in plaats van alle vier. Ze gebruiken het 2s-elektron en twee van de 2P-elektronen, maar laten het andere 2P-elektron ongewijzigd.