het chemische element aluminium wordt geclassificeerd als een ander metaal. Het werd ontdekt in de jaren 1750 door Andreas Marggraf.,

Data Zone
| Classification: | Aluminum is an ‘other metal’ |
| Color: | silvery |
| Atomic weight: | 26.98154 g/mol |
| State: | solid |
| Melting point: | 660.32 oC, 933.57 K |
| Boiling point: | 2466.85 oC, 2740.,00 K |
| Electrons: | 13 |
| Protons: | 13 |
| Neutrons in most abundant isotope: | 14 |
| Electron shells: | 2,8,3 |
| Electron configuration: | 1s2 2s2 2p6 3s2 3p1 |
| Density @ 20oC: | 2.702 g/cm3 |
Show more, including: Heats, Energies, Oxidation,
Reactions, Compounds, Radii, Conductivities
| Atomic volume: | 9.,98 cm3/mol | ||
| Structure: | fcc: face-centered cubic | ||
| Hardness: | 2.8 mohs | ||
| Specific heat capacity | 0.90 J g-1 K-1 | ||
| Heat of fusion | 10.790 kJ mol-1 | ||
| Heat of atomization | 326 kJ mol-1 | ||
| Heat of vaporization | 293.40 kJ mol-1 | ||
| 1st ionization energy | 577.6 kJ mol-1 | ||
| 2nd ionization energy | 1816.6 kJ mol-1 | ||
| 3rd ionization energy | 2744.,7 kJ mol-1 | ||
| Electron affinity | 42.6 kJ mol-1 | ||
| Minimum oxidation number | 0 | ||
| Min. common oxidation no. | 0 | ||
| Maximum oxidation number | 3 | ||
| Max. common oxidation no. | 3 | ||
| Electronegativity (Pauling Scale) | 1.61 | ||
| Polarizability volume | 8.,> | Reaction with 15 M HNO3 | passivated |
| Reaction with 6 M HCl | mild, ⇒ H2, AlCl3 | ||
| Reaction with 6 M NaOH | mild, ⇒ H2, – | ||
| Oxide(s) | Al2O3 | ||
| Hydride(s) | AlH3 | ||
| Chloride(s) | AlCl3 & Al2Cl6 | ||
| Atomic radius | 125 pm | ||
| Ionic radius (1+ ion) | – | ||
| Ionic radius (2+ ion) | – | ||
| Ionic radius (3+ ion) | 53.,5 pm | ||
| Ionic radius (1- ion) | – | ||
| Ionic radius (2- ion) | – | ||
| Ionic radius (3- ion) | – | ||
| Thermal conductivity | 237 W m-1 K-1 | ||
| Electrical conductivity | 37.6676 x 106 S m-1 | ||
| Freezing/Melting point: | 660.32 oC, 933.,57 K |
Louis de Morveau geloofde dat er een nieuw metaal kon worden ontdekt in het oxidealuminium. Hij had gelijk, maar hij kon het niet isoleren. De Morveau bedacht de eerste systematische methode om chemicaliën te benoemen, en zoals we kunnen zien, was hij een baanbrekend ballonvaarder.,
Aluminum’s Periodic Table
Neighborhood
| Group 2 or 12 |
Group 13 |
Group 14 |
|
| 2 | 4 Be |
5 B |
6 C |
| 3 | 12 Mg |
13 Al |
14 Si |
| 4 | 30 Zn |
31 Ga |
32 Ge |
Discovery of Aluminum
mensen gebruiken aluin sinds de oudheid voor verven, looien en het stoppen van bloeden. Aluin is kalium aluminium sulfaat.in de jaren 1750 ontdekte Andreas Marggraf dat hij een alkali-oplossing kon gebruiken om een nieuwe stof uit aluin te precipiteren. In 1746 was Marggraf de eerste die zink isoleerde.de stof Marggraf, verkregen uit aluin, werd in 1760 door de Franse chemicus Louis de Morveau benoemd tot aluminiumoxide. We weten nu dat aluminiumoxide aluminiumoxide is – chemische formule Al2O3.,
de Morveau geloofde dat aluminiumoxide een nieuw metaalelement bevatte, maar hij was, net als Marggraf, niet in staat dit metaal uit het oxide te halen. (1), (2)
in 1807 of 1808 ontleedde de Engelse chemicus Humphry Davy aluminiumoxide in een elektrische boog om een metaal te verkrijgen. Het metaal was niet puur aluminium, maar een legering van aluminium en ijzer.
Davy noemde het nieuwe metaalalumium en hernoemde het vervolgens naar aluminium. (3)
Aluminium werd voor het eerst geïsoleerd in 1825 door Hans Christian Ørsted (Oersted) in Kopenhagen, Denemarken, die meldde: “een klomp metaal dat in kleur en glans enigszins lijkt op tin.,”
Ørsted produceerde aluminium door het verminderen van aluminiumchloride met behulp van een kalium-kwik amalgaam. Het kwik werd verwijderd door verwarming om aluminium te verlaten. de Duitse chemicus Friedrich Wöhler (Woehler) herhaalde Ørsted ‘ s experiment, maar vond dat het alleen kaliummetaal opleverde. Wöhler ontwikkelde de methode verder twee jaar later, reageren volatalized aluminium trichloride met kalium om kleine hoeveelheden aluminium te produceren. (1) in 1856 verklaarde Berzelius dat het Wöhler was die in 1827 was geslaagd. Wöhler krijgt dan ook meestal krediet voor de ontdekking.,
recenter herhaalde Fogh de oorspronkelijke experimenten en heeft aangetoond dat de methode van Ørsted bevredigende resultaten kan opleveren. dit heeft de prioriteit van Ørsted ‘ s oorspronkelijke werk en zijn positie als ontdekker van aluminium versterkt. (4) gedurende bijna drie decennia bleef aluminium een nieuwigheid, duur om te produceren en waardevoller dan goud, totdat Henri Saint-Claire Deville in Parijs in 1854 een manier vond om kalium te vervangen door veel goedkoper natrium in de reactie om aluminium te isoleren., Aluminium werd toen populairder, maar omdat het nog steeds vrij duur was, werd het gebruikt in sier in plaats van praktische situaties.in 1886 vonden de Amerikaanse chemicus Charles Martin Hall en de Franse chemicus Paul Héroult onafhankelijk van elkaar Het Hall-Héroultproces uit, dat aluminiummetaal goedkoop elektrolytisch isoleert uit het oxide.
aluminium wordt nog steeds vervaardigd volgens het Hall-Héroult-proces.
interessante feiten over aluminium
- aluminiumproductie kost veel energie – 17.,4 megawatt uur elektrische energie om een metrische ton aluminium te produceren; dat is drie keer meer energie dan nodig is om een metrische ton staal te maken. (5)
- aluminium is een geweldig metaal om te recyclen. Recycling gebruikt slechts 5% van de energie die nodig is om aluminium te produceren uit zijn erts, bauxiet. (6)
- Aluminium kleeft onder normale omstandigheden niet aan magneten.
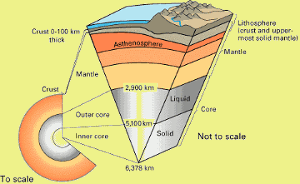
- Er zit meer aluminium in de aardkorst dan enig ander metaal. Met ongeveer 8 procent is aluminium het op twee na meest voorkomende element in de aardkorst, na zuurstof en silicium.,ondanks zijn grote overvloed was aluminium in de jaren 1850 waardevoller dan goud. In 1852 werd aluminium geprijsd op $ 1200 per kg en goud was $ 664 per kg.de aluminiumprijzen illustreren de gevaren van financiële speculatie: in 1854 vond Saint-Claire Deville een manier om kalium te vervangen door veel goedkoper natrium in de reactie om aluminium te isoleren. In 1859, aluminium was geprijsd op $ 37 per kg; de prijs was gedaald 97% in slechts vijf jaar.,
- waar het vorige item de gevaren van speculatie belicht, belicht dit item een van de triomfen van de chemie: het Hall-Heroult elektrolytische proces werd ontdekt in 1886. In 1895 was de prijs van aluminium gedaald tot slechts $ 1,20 per kg. robijnstenen zijn voornamelijk aluminiumoxide waarin een klein aantal aluminiumionen is vervangen door chroomionen.
- aluminium wordt gemaakt in de kernbranden van zware sterren wanneer een proton magnesium toevoegt. (Magnesium wordt zelf gemaakt in sterren door kernfusie van twee koolstofatomen.,) (7)


uiterlijk en kenmerken
schadelijke effecten:
geen bewezen problemen; ingestie kan de ziekte van alzheimer veroorzaken
kenmerken:
aluminium is een zilverwit metaal., Het kleeft niet aan magneten (het is paramagnetisch en dus is het magnetisme onder normale omstandigheden zeer, zeer zwak). Het is een uitstekende elektrische geleider. Het is van lage dichtheid en hoge rekbaarheid. Het is te reactief om algemeen te worden gevonden Als de metal, hoewel, zeer zelden, de inheemse metal kan worden gevonden. (8)
het uiterlijk van aluminium wordt afgestompt en de reactiviteit ervan wordt gepassiveerd door een laag aluminiumoxide die zich onder normale omstandigheden van nature op het oppervlak van het metaal vormt. De oxidefilm resulteert in een materiaal dat bestand is tegen corrosie., De film kan worden verdikt met behulp van elektrolyse of oxiderende middelen en aluminium in deze vorm zal weerstaan aanval door verdunde zuren, verdunde alkaliën en geconcentreerd salpeterzuur.
Aluminium ligt voldoende ver aan de rechterkant van het periodiek systeem dat het enige hints van niet – metalen gedrag vertoont, reageren met hete alkaliën om aluminiumionen te vormen-evenals de meer typische metaalreactie met zuren om waterstofgas vrij te geven en het positief geladen metaalion, Al3+, te vormen. aluminium is amfoterisch.
zuiver aluminium is vrij zacht en niet sterk., Aluminium gebruikt in commerciële toepassingen heeft kleine hoeveelheden silicium en ijzer (minder dan 1%) toegevoegd, wat resulteert in sterk verbeterde sterkte en hardheid.
gebruik van aluminium
als gevolg van zijn lage dichtheid, lage kosten en corrosiebestendigheid, aluminium wordt veel gebruikt over de hele wereld.
Het wordt gebruikt in een uitgebreid assortiment van producten, van drankblikjes tot raamkozijnen en boten tot vliegtuigen. Een Boeing 747-400 bevat 66.150 kg hoogwaardig aluminium.in tegenstelling tot sommige metalen heeft aluminium geen aroma – vandaar het wijdverbreide gebruik in voedselverpakkingen en Kookpotten.,
hoewel niet zo goed als zilver of koper, is aluminium een uitstekende elektrische geleider. Het is ook aanzienlijk goedkoper en lichter dan deze metalen, dus het wordt veel gebruikt in bovengrondse hoogspanningslijnen.
van alle metalen wordt alleen ijzer op grotere schaal gebruikt dan aluminium.
abundantie en isotopen
abundantie aardkorst: 8,23 gewichtsprocent, 6,32 mol
abundantie zonnestelsel: 56 ppm gewichtsprocent, 2,7 ppm mol
kosten, zuiver: $15,72 per 100 g
kosten, bulk: $0.,20 per 100g
bron: aluminium is het meest voorkomende metaal in de aardkorst en het derde meest element in de aardkorst, na zuurstof en silicium. Aluminium is te reactief om puur te worden gevonden. Bauxiet (voornamelijk aluminiumoxide) is het belangrijkste erts.
isotopen: 15 waarvan de halfwaardetijden bekend zijn, massanummers 22 tot 35. Hiervan komen er slechts twee van nature voor: 27Al, dat stabiel is, en 26Al, dat radioactief is met een halfwaardetijd van 7,17 x 105 jaar. 26Al wordt gevormd door een kosmische straalbombardement van argon in de atmosfeer van de aarde.,

Cite this Page
voor online linken kopieer en plak een van de volgende opties:
<a href="https://www.chemicool.com/elements/aluminum.html">Aluminum</a>
of
<a href="https://www.chemicool.com/elements/aluminum.html">Aluminum Element Facts</a>
om deze pagina in een academisch document te citeren, gelieve de volgende MLA-compliant citaat te gebruiken:
"Aluminum." Chemicool Periodic Table. Chemicool.com. 26 Jul. 2014. Web. <https://www.chemicool.com/elements/aluminum.html>.