Hoe werkt een buffer?
een buffer is bestand tegen pH-verandering omdat de twee componenten (geconjugeerd zuur en geconjugeerde base) beide in aanzienlijke hoeveelheden aanwezig zijn bij evenwicht en in staat zijn om kleine hoeveelheden andere zuren en basen (in de vorm van H3O+ en OH -) te neutraliseren wanneer ze aan de oplossing worden toegevoegd. Om dit effect te verduidelijken, kunnen we het eenvoudige voorbeeld van een fluorwaterstofzuur (HF) en natriumfluoride (NaF) buffer beschouwen., Fluorwaterstofzuur is een zwak zuur als gevolg van de sterke aantrekkingskracht tussen de relatief kleine F – ion en solvated protonen (H3O+), waardoor het niet volledig kan dissociëren in water. Daarom, als we HF in een waterige oplossing verkrijgen, stellen we het volgende evenwicht vast met slechts een geringe dissociatie (Ka(HF) = 6.6×10-4, sterk voorstander van reactanten):
\
We kunnen dan natriumfluoride toevoegen en oplossen in de oplossing en de twee mengen tot we het gewenste volume en pH bereiken waarop we willen bufferen., Als natriumfluoride oplost in water, gaat de reactie naar voltooiing, dus verkrijgen we:
\
aangezien Na+ het conjugaat is van een sterke base, zal het geen effect hebben op de pH of reactiviteit van de buffer. De toevoeging van \(NaF\) aan de oplossing zal echter de concentratie van F – in de bufferoplossing verhogen, en bijgevolg, volgens het principe van Le Chatelier, ook leiden tot iets minder dissociatie van de HF in het vorige evenwicht. De aanwezigheid van significante hoeveelheden van zowel het geconjugeerde zuur, \(HF\), als de geconjugeerde base, F -, staat de oplossing toe om als buffer te functioneren., Deze buffering actie kan worden gezien in de titratie curve van een buffer oplossing.
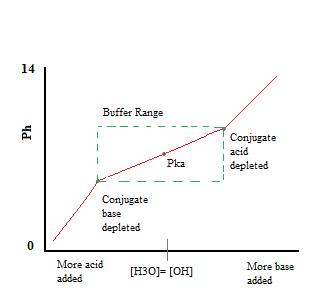
zoals we kunnen zien, over het werkbereik van de buffer. pH verandert zeer weinig met de toevoeging van zuur of base. Zodra de buffercapaciteit wordt overschreden, springt de snelheid van pH-verandering snel. Dit komt voor omdat het geconjugeerde zuur of de geconjugeerde base door neutralisatie is uitgeput. Dit principe impliceert dat een grotere hoeveelheid geconjugeerd zuur of base een grotere buffercapaciteit zal hebben.,
als zuur werd toegevoegd:
\
In deze reactie zal de geconjugeerde base, F -, het toegevoegde zuur, H3O+ neutraliseren, en deze reactie wordt voltooid, omdat de reactie van F – met H3O+ een evenwichtsconstante heeft die veel groter is dan één. (In feite is de evenwichtsconstante de reactie zoals geschreven is gewoon de inverse van de Ka voor HF: 1 / Ka ( HF) = 1/(6.6×10-4) = 1.5×10+3.,) Zolang er meer F – dan H3O+ is, zal bijna alle H3O+ verbruikt worden en zal het evenwicht naar rechts verschuiven, waardoor de concentratie van HF lichtjes toeneemt en de concentratie van F-lichtjes afneemt, maar waardoor de hoeveelheid H3O+ nauwelijks verandert zodra het evenwicht hersteld is.,
indien base werd toegevoegd:
\
in deze reactie zal het geconjugeerde zuur, HF, toegevoegde hoeveelheden base, OH-neutraliseren en zal het evenwicht weer naar rechts verschuiven, waardoor de concentratie van F – in de oplossing licht toeneemt en de hoeveelheid HF licht afneemt. Nogmaals, omdat de meeste OH-geneutraliseerd is, zal er weinig pH verandering optreden.
deze twee reacties kunnen heen en weer blijven wisselen met weinig pH verandering.