Een zuur-base (proton transfer) reactie
Voor ons eerste voorbeeld van de chemische reactiviteit, laten we eens kijken naar een heel simpele reactie die optreedt tussen het hydroxide ion en zoutzuur:
HCl+OH^- \Rightarrow H_20+Cl^-
Dit is een zuur-base reactie: een proton wordt overgedragen van HCl, de zuur te hydroxide, de basis. Het product is water (het geconjugeerde zuur van hydroxide) en chloride-ion (de geconjugeerde base van HCl)., Je hebt deze reactie ongetwijfeld eerder gezien in de Algemene Chemie. Ondanks zijn eenvoud (en ondanks het feit dat de reagentia en producten anorganisch zijn in plaats van organisch), stelt deze reactie ons in staat om voor het eerst veel van de fundamentele ideeën van organische chemie te overwegen die we in verschillende contexten zullen onderzoeken in deze tekst.
De sleutel tot het begrijpen van zowat elk reactiemechanisme is het concept van elektronendichtheid, en hoe het verbonden is met de elektronenbeweging (bindingen breken en bindingen vormen) die optreedt in een reactie., Het hydroxide-ion-in het bijzonder het elektronegatieve zuurstofatoom in het hydroxide – ion-heeft een hoge elektrondichtheid door negatieve lading en de polariteit van de waterstof-zuurstofbinding. De hydroxide zuurstof is elektronenrijk.

het waterstofatoom in HCl heeft daarentegen een lage elektronendichtheid: het is elektronenarm. Zoals je zou verwachten, wordt iets dat elektronenrijk is aangetrokken door iets dat elektronenarm is., Als hydroxide en HCl dichter bij elkaar bewegen, wordt een eenzaam paar elektronen op de elektronenrijke hydroxide zuurstof aangetrokken door het elektron-arme proton van HCl, en elektronenbeweging vindt plaats richting het proton. De twee elektronen in de waterstof-chloor sigma binding worden afgestoten door deze naderende hydroxide elektronendichtheid, en bewegen daarom nog verder weg van het proton en naar de chloorkern., Het gevolg van al deze elektronenbeweging is dat de waterstof-chloorbinding wordt verbroken, omdat de twee elektronen van die binding volledig loskomen van de 1s-baan van de waterstof en een eenzaam paar worden in de 3P-baan van een chloride-anion.
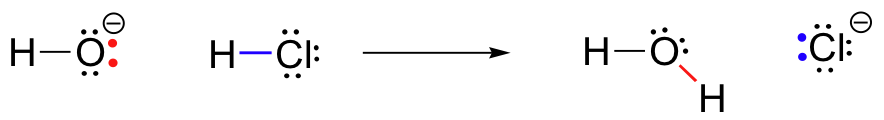
Op hetzelfde moment dat de waterstof-chloorbinding breekt, vormt zich een nieuwe sigmabinding tussen waterstof en zuurstof, die de twee elektronen bevat die voorheen een enkel paar op hydroxide waren. Het resultaat van deze bindingsvorming is natuurlijk een watermolecuul.
eerder (paragraaf 6.1.,), zagen we hoe gebogen pijlen werden gebruikt om elektronen beweging die optreedt in chemische reacties weer te geven, waar bindingen worden gebroken en nieuwe bindingen worden gevormd. De HCl + OH-reactie bijvoorbeeld wordt afgebeeld door twee gebogen pijlen te tekenen.
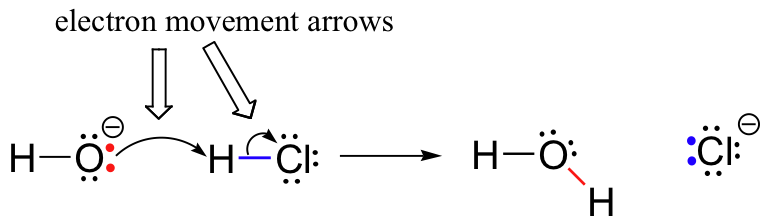
de eerste pijl vindt zijn oorsprong in een van de eenzame paren op het zuurstofhydroxide en wijst naar het H-symbool in het waterstofbromidemolecuul, wat de ‘aanval’ van het zuurstof eenzame paar en de daaropvolgende vorming van de nieuwe waterstof-zuurstofbinding illustreert., De tweede gebogen pijl begint bij de waterstof-broombinding en wijst naar het ‘ Br ‘ – symbool, wat aangeeft dat deze binding breekt – de twee elektronen ‘vertrekken’ en worden een eenzaam paar op bromide-ion.
Het is erg belangrijk om op dit punt te benadrukken dat deze gebogen, twee-prikkelde pijlen altijd de beweging van twee elektronen vertegenwoordigen. Het grootste deel van dit boek zal gewijd zijn aan de beschrijving van reactiemechanismen met twee-elektronen beweging, dus deze full-headed pijlen zullen zeer vertrouwd worden.,

in het tweede semester zullen we echter kijken naar radicale reactiemechanismen, waar een elektron beweging optreedt. Voor deze processen wordt een gebogen pijl met één prikkel (‘vishaak’) gebruikt.
oefening
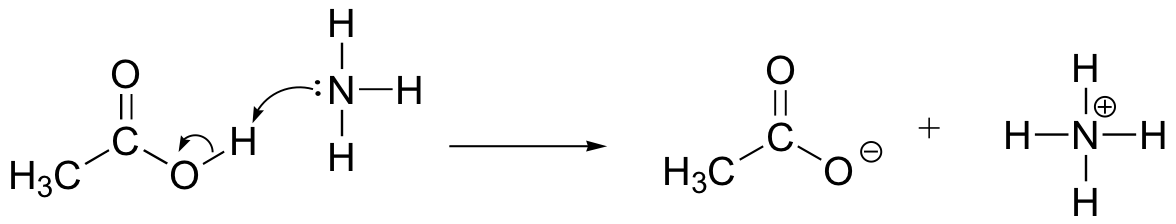
teken pijlen voor elektronenbeweging om de zuur-base reactie tussen azijnzuur, CH3COOH en ammoniak, NH3 te illustreren. Trek de volledige Lewis structuren van reagentia en producten.