Inleiding
het begrijpen en beheren van V/Q relaties vertegenwoordigt een steen van de intensive care unit (ICU) patiëntenmanagement. De V / Q relatie (Fig. 1) kan worden gezien als een spectrum tussendeadspace (oneindige V/Q) en shunt (nul V/Q).
wanneer pulmonair capillair bloed wordt blootgesteld aan een alveolaire partiële druk van zuurstof (PAO2), bewegen zuurstofmoleculen in het plasma als opgelost O2 en blijven ze een partiële druk uitoefenen.,
De meeste van deze zuurstofmoleculen combineren onmiddellijk methemoglobine en komen in een toestand waarin ze niet langer direct partiële druk uitoefenen. Dit proces gaat door tot een partiële drukstraal tussen de alveolus en het plasma niet meer bestaat, op welk punt de hemoglobine maximaal verzadigd is voor het bloedpo2.
hoewel de in het plasma opgeloste zuurstof slechts 1,5% tot 3% van de totale zuurstof in het bloed uitmaakt, is de PO2-waarde belangrijk omdat deze de drijfkracht bepaalt voor de beweging van zuurstof in en uit het bloed., een perfecte bloeduitwisseling zou vereisen dat elke alveolus perfect geventileerd wordt en dat al het bloed uit de rechterventrikel wordt uitgeworpen tot volledig functionele pulmonale capillairen. Bovendien zou de verspreiding over het alveolaire / capillaire membraan unimpeded moeten zijn.
omdat al het bloed dat van het rechter ventrikel naar het linker ventrikel gaat perfect in evenwicht zou komen met alveolarga ‘ s, zouden de alveolaire PO2 (PAO2) en de arteriële PO2 (PaO2) identiek zijn.
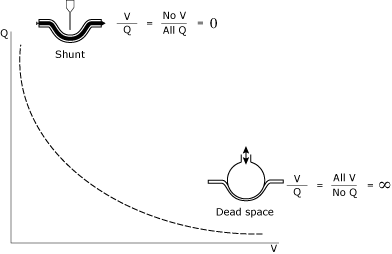
FIG. 1., De wiskundige en conceptuele illustratie van shunt en deadspace.
zoals afgebeeld in Fig. 2, oxygenatie in de normale longen kunnen verschillen van de ideale situatie omdat de verdeling van perfusie ongelijk is.
relatief meer bloedstroom treedt op in de zones die afhankelijk zijn van de zwaartekracht, en sommige veneuze drainage (uit de bronchiale, pleurale en Thebese aderen) ledigt rechtstreeks in de linkerzijde van het hart, waardoor het normale zuurstofmechanisme wordt omzeild (rangeren).,
hierdoor komt een deel van het bloed in de linker hartkamer met een lager zuurstofgehalte dan het bloed dat overgaat met een ideale alveolus. Figuur 3 geeft het resulterende lagere PaO2-niveau weer in vergelijking met de berekende ideale zuurstofspanning.
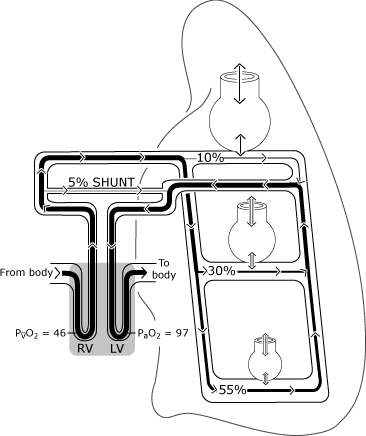
FIG. 2. De normale Long heeft een onvolmaakte verdeling van de ventilatie en perfusie die voornamelijk wordt bepaald door de zwaartekracht. De afbeelding gaat uit van een rechtopstaande houding, zodat de longbasen zich in de zwaartekracht-afhankelijke positie bevinden., De niet-zwaartekracht-afhankelijke alveoli zijn groter, maar ontvangen minder gasuitwisseling (ventilatie) dan de zwaartekracht-afhankelijke alveoli. De verdeling van de perfusie wordt voornamelijk bepaald door de zwaartekracht, waarbij ongeveer 55% stroomt naar de zwaartekrachtafhankelijke gebieden, 30% naar de middenlonggebieden en 10% naar de niet-zwaartekrachtafhankelijke longgebieden. PaO2 en PvO2 worden uitgedrukt in mmHg (kPa = mmHg × 0,133); RV = rechter ventrikel; LV = linker ventrikel. Gereproduceerd met toestemming van Elsevier Health Sciences.
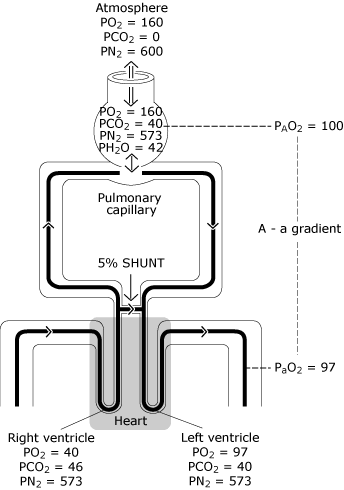
FIG. 3., De normale Long heeft een imperfecte verdeling van de ventilatie, een imperfecte verdeling van de perfusie en een minimale mate van intrapulmonale rangeren. Het resultaat is een afname van PO2 van de berekende ideale alveolaire waarde (PAO2) tot de gemeten systemische arteriële bloedwaarde (PaO2). Dit PO2 verschil staat bekend als” de alveolaire-arteriële zuurstof spanningsgradiënt”. PO2 = zuurstofspanning uitgedrukt in mmHg; PCO2 = kooldioxidespanning uitgedrukt in mmHg; PN2 = stikstofspanning uitgedrukt in mmHg; PH2O = waterdampspanning uitgedrukt in mmHg. (kPa = mmHg × 0,133)., Gereproduceerd met toestemming van Elsevier Health Sciences.
Shunt en hypoxemie
anatomische rangering wordt gedefinieerd als bloed dat van de rechterzijde naar de linkerzijde van het hart gaat zonder pulmonarycapillairen te doorkruisen. Capillaire rangeren wordt gedefinieerd als bloed dat gaat van de rechterkant van het hart naar de linkerkant van het hart viapulmonale capillairen die grenzen aan niet-geventileerde alveoli.
in beide gevallen kan bloed in de linksomcirculatie komen zonder een toename van het zuurstofgehalte., Dit wordt aangeduid als nul V / Q, ortrue rangeren, omdat het bloed geen kans voor gasexchange met functionele alveoli heeft gehad.
een voorbeeld van rangeren in de klinische setting zijn de afwijkingen in de gasuitwisseling die in pneumonie worden waargenomen door het vrijkomen van endotoxine dat leidt tot cellulair oedeem en vasoconstrictie .
rangeren en hypoxemie zijn geen synonieme termen, noch hebben ze lineaire relaties. Het hypoxemisch effect van een shunt zal niet alleen afhangen van de grootte van de shunt, maar ook van de oxygenatiestatus van het veneuze bloed dat shunt(SVO2)., Een kleine shunt met een lage Svo2 kan diepgaande hypoxemische effecten hebben,terwijl een grote shunt met een hoge SvO2 minder significante hypoxemie zal veroorzaken.
Er kan ondubbelzinnig worden gesteld dat wanneer hypoxemie bestaat, enige graad van rangeren (intrapulmonaal of intracardiaal) aanwezig moet zijn; het effect van shunt op het PaO2 hangt echter sterk af van de cardiovascularfunctie en de metabolische snelheid. Arteriële hypoxemie is een gevolg van longfunctie, cardiovasculaire functie en metabolisme.,
beoordeling van thelungs als oxygenator is essentieel voor de behandeling van veel patiënten die cardiopulmonale ondersteunende zorg nodig hebben. Berekening van intrapulmonale rangering is de beste beschikbare manier om te bepalen in hoeverre het longstelsel bijdraagt tothypoxemie.
intrapulmonale shunt
zoals eerder vermeld, wordt de intrapulmonale shunt gedefinieerd als deportie van de cardiale output die de linkerkant van het hart binnenkomt zonder een perfecte gasuitwisseling met volledig functionalalveoli te ondergaan. Intrapulmonale shunt kan worden onderverdeeld in driecomponenten.,
- anatomische rangering werd eerder beschreven als bloed dat de linkerzijde van het hart binnendringt zonder de pulmonale capillairen te passeren. Naast normale anatomische rangeren van bronchiale, pleurale en thebesiaanse aderen, anatomische rangeren kan worden verhoogd door vasculaire longtumoren en rechts-naar-links intracardiale shunts.
- capillaire rantering wordt veroorzaakt wanneer het bloed door de pulmonale capillairen loopt, maar niet equilibreert met alveolair gas als gevolg van pathologische processen zoals atelectase, pneumonie en acuut longletsel.,
- veneuze vermenging treedt op wanneer het bloed equilibreert met een alveolaire PO2 die minder dan ideaal is, zoals in situaties met een lage V / Q . Omdat veneuze vermenging geen echte shunt is, leidt dit soms tot verwarring. De som van anatomische en capillaire shunts wordt meestal nul V / Q of echte shunt genoemd. Veneuze vermenging wordt vaak aangeduid als lage V / Q of “shunt effect”. Fysiologische shunt in normale of niet-zieke longen is een meting van normale intrapulmonale shunt. In de setting van pulmonale pathologie vertegenwoordigt fysiologische shunt voornamelijk de ernst van de ziektetoestand.,
de shuntvergelijking
de vergelijking die wordt gebruikt om het shuntgedeelte van de cardiale output te berekenen, gaat ervan uit dat het niet-rangeergas perfectoxygeneert door uitwisseling met perfect alveolair gas.
hoewel het concept van de intrapulmonale shunt geen regionale relatie weerspiegelt, zoals het concept van de ventilatieperfusie, weerspiegelt het wel de mate waarin de long afwijkt van het ideaal als anoxygenator van longbloed.
Het is dit kwantitatieve vermogen om als oxygenator naar de longen te kijken dat deze meting uniek en waardevol maakt in de klinische setting., Dit overzicht maakt gebruik van de fysiologische shunt in verwijzing naar de intrapulmonale shunt berekend met de patiënt ademen minder dan 100% zuurstof.
de afleiding van de shuntvergelijking komt uit de concepten ofFick. In 1870 introduceerde hij de klassieke relatie dat de hoeveelheid zuurstof die beschikbaar is voor weefselgebruik per tijdseenheid het arteriële zuurstofgehalte (CaO2)vermenigvuldigd met de hoeveelheid arterieel bloed die aan de tissues per tijdseenheid wordt gepresenteerd (d.w.z., cardiale output, Qt).,
vergelijking 1:
beschikbare zuurstof =(Qt)(CaO2)
naar de longen geretourneerde zuurstof omvat de cardiale output(Qt) vermenigvuldigd met het gemengde veneuze zuurstofgehalte(cvo2).
vergelijking 2:
Oxygen returned =(Qt)(CvO2)
zuurstofverbruik per tijdseenheid (VO2) moet de zuurstof weerspiegelen die in die tijdsperiode uit het bloed is geëxtraheerd.,
vergelijking 3:
VO2 = (Qt)(CaO2)– (Qt)(CvO2)
vergelijking 3 kan dan worden herschreven als wat klassiek wordt beschreven als de Fick-vergelijking.
vergelijking 4:
VO2 = Qt(CaO2 –CvO2)
herschikt algebraïsch kan vergelijking 4 worden uitgedrukt als een functie van cardiale output.,
vergelijking 5:
Qt = VO2/(CaO2 –CvO2)(10)
om de cardiale output in liters per minuut uit te drukken moet de oxygendifferentie met een factor 10 worden vermenigvuldigd.
twee andere vergelijkingen waarmee men vertrouwd moet raken zijn de klassische shuntvergelijking (vergelijking 6), die de verhouding beschrijft tussen shunted cardiac output en total cardiac output(QS/Qt). Het wordt gemeten met de patiënt ademende 100% zuurstof.,
vergelijking 6:
QS/Qt = (CcO2 –CaO2)/(CcO2 –Cvo2)
de fysiologische shuntvergelijking (QSP/Qt) is een andere manier om Vergelijking 6 uit te drukken wanneer de patiënt minder dan 100% zuurstof ademt en er bestaat een veneuze vermenging.Vandaar de fysiologische shunt vergelijking is:
Vergelijking 7:
QSP/Qt = (CcO2 –CaO2)/ (CcO2 –CvO2)
De QSP/Qt heeft het voordeel van beingderived in verhouding dus dat er geen absolute maat van de cardiac output isrequired., In deze vorm toont de vergelijking duidelijk aan dat, naarmate de shunted cardiale output nul nadert, het arteriële zuurstofgehalte het theoretische einde van de longcapillaryoxygengehalte moet benaderen.
zolang een deel van het cardiale output niet perfect uitwisselt met perfecte alveoli, moet het arteriële zuurstofgehalte lager zijn dan het ideale longcapillaire zuurstofgehalte aan het eind.
de implicaties van de fysiologische shuntvergelijking kunnen worden geconceptualiseerd door de termen zuurstofgehalte(CcO2, CaO2,CvO2) te beschouwen als entiteiten die in een container kunnen worden gegoten (Fig. 4)., Bepaalde factoren, zoals hemoglobinconcentratie, kunnen van invloed zijn op alle drie de niveaus.
de belangrijkste klinische variabele die van invloed is op CcO2 isFiO2, terwijl zowel de totale cardiale output als het zuurstofverbruik van invloed zijn op CvO2. Veranderingen in de fysiologische shunt beïnvloeden CaO2.
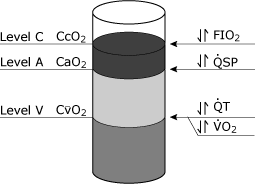
FIG. 4. Schematische weergave van bloedzuurstofniveaus die theoretisch kunnen worden verkregen uit drie afzonderlijke plaatsen in het cardiovasculaire systeem. Niveau C staat voor het zuurstofgehalte in het longcapillair bloed (cco2)., Niveau A vertegenwoordigt het systemische arteriële zuurstofgehalte in het bloed (CaO2), en niveau V vertegenwoordigt het gemengde veneuze (longslagader) zuurstofgehalte in het bloed (CvO2). De meest voorkomende klinische variabelen die specifiek van invloed zijn op deze verschillende niveaus worden getoond: niveau C wordt het meest beïnvloed door veranderingen in FIO2 (geïnspireerde zuurstoffractie), niveau A wordt specifiek beïnvloed door veranderingen in de fysiologische shunt (QSP), niveau V wordt specifiek beïnvloed door zowel de totale cardiale output (QT) en de snelheid van zuurstofverbruik (VO2). Gereproduceerd met toestemming van Elsevier Health Sciences.,
De teller van de shuntvergelijking wordt weergegeven door verschillen in CcO2 en cao2. De noemer van de vergelijking wordt weergegeven door de verschillen in CcO2 en cvo2.
veranderingen van ongelijke grootte tussen deze drie niveaus zullen de verhouding veranderen, die gelijk is aan veranderingen in de fysiologische shuntberekening.
indien een patiënt een ernstige rechts-, midden – en onderkwabconsolidatie ontwikkelt, zouden de metingen van het arteriële en longslagader bloedgas een klinisch beeld geven zoals weergegeven in Fig. 5.,
de arteriële oxygentensie en de arteriële inhoud zijn significant afgenomen als gevolg van een grote intrapulmonale shunt. Als de cardiale output onveranderd blijft en arterieel-gemengd veneus zuurstofverschil niet verandert, dan moet het CvO2 ook afnemen.
vanwege de ongelijke grootteverandering zal de fysiologische shunt sterk toenemen als gevolg van hypoxemie.
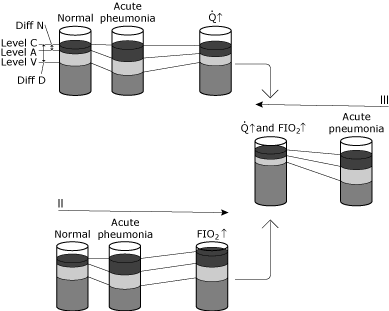
FIG. 5. Schematische weergave van veranderingen in bloedzuurstofniveaus onder verschillende omstandigheden., Het doel van deze illustratie is om het verschil tussen physiologic rangeren en het hypoxemic effect van physiologic rangeren te conceptualiseren. I, II en III illustreren veranderingen in een normaal individu die pneumonitis oploopt die een significante toename van intrapulmonale rangeergedrag veroorzaakt zonder enige compenserende fysiologische verandering., De status van normale naar acute longontsteking laat zien: geen verandering in niveau C omdat ventilatie en FIO2 onveranderd zijn, een specifieke daling in niveau A als gevolg van verhoogde rangeerpraktijken veroorzaakt door de longontsteking, en een daling in niveau V omdat het av-gehalte verschil onveranderd is (cardiale output en zuurstofverbruik onveranderd). Aangezien Diff N in grotere mate is toegenomen dan Diff D, neemt de berekende shunt toe. Conditie 1 toont een verhoogde cardiale output (Q↑) Als reactie op de acute hypoxemie. Niveau C blijft ongewijzigd aangezien noch ventilatie noch FIO2 is gewijzigd., Het av-gehalte verschil is verkleind omdat de cardiale output is toegenomen, terwijl het zuurstofverbruik onveranderd blijft. De toename van niveau V resulteert in een nieuw dynamisch evenwicht waarbij niveau A ook wordt verhoogd. Merk op dat de relatie tussen Diff N en Diff D slechts lichtjes veranderd is. Dus, niveau A (en dus de PaO2) is toegenomen met weinig verandering in de berekende shunt. In dit geval is de compensatie voor hypoxemie cardiovasculair; de intrapulmonale shunt is niet veranderd. Conditie II toont een verhoogde zuurstofconcentratie (FIO2↑)., Niveau C neemt toe, terwijl het verschil in Av-gehalte onveranderd blijft (hartminuutvolume en zuurstofverbruik onveranderd). Een nieuw dynamisch evenwicht resulteert in niveau A (en daardoor neemt de PaO2 toe). De relatie tussen Diff N en Diff D is slechts licht gewijzigd. Niveau A (en dus PaO2) is toegenomen met weinig verandering in de berekende shunt. In dit geval, compensatie voor hypoxemie is via zuurstoftherapie; de intrapulmonale shunt is in wezen onveranderd. Conditie III toont zowel cardiale output als geïnspireerde zuurstofconcentratie veranderingen (Q↑ en FIO2↑)., Let op de sterke toename van niveau A (en dus PaO2) met weinig verandering in Diff n/Diff D. weergegeven met toestemming van Elsevier Health Sciences.
ernstige hypoxemie zal gewoonlijk leiden tot een toename van de cardiacoutput. Dit resulteert in een afname van het arterieel-veneuze oxygencontentverschil zoals weerspiegeld door een toename inCvO2.
een nieuw evenwicht zal resulteren in een toename van CaO2 zonder een verandering in verhouding(QSP/Qt). De arteriële PO2 verbetert sterk, zonder een significante verandering in fysiologische shuntsecondaire, als gevolg van een verbeterde cardiale output.,
als wordt aangenomen dat deze patiënt extra zuurstof krijgt toegediend terwijl de cardiale output ongewijzigd blijft, wordt CcO2 verhoogd secundair aan een verhoogde alveolaire PO2. Aangezien de fysiologische shunt hetzelfde blijft en het arterieel-veneuze zuurstofgehalte hetzelfde blijft, leidt een nieuw evenwicht tot een toename van het Cvo2-en het cvo2-gehalte.
ten slotte worden de omstandigheden veranderd om een patiënt met zuurstoftherapie en een toename van het cardiale output weer te geven.CaO2 neemt toe omdat zowel cco2 als CvO2 toenemen.Hypoxemie verbetert terwijl de verhouding (QSP / QT) onveranderd blijft.,
de fysiologische shuntberekening kan op betrouwbare wijze de mate van gasuitwisseling weergeven die toe te schrijven is aan intrapulmonale ziekte of intracardiale shunting, ongeacht andere factoren die ook een rol kunnen spelen.
omdat meerdere oorzaken van hypoxemie vaak worden aangepakt bij ernstig zieken, is het vermogen om de graad van intrapulmonale pathofysiologie te kwantificeren een uiterst belangrijk hulpmiddel.
hoe de shunt te bepalen
De intrapulmonale shunt kan alleen worden gemeten wanneer zowel arteriële als pulmonale arteriële bloedmonsters beschikbaar zijn en de FIO2 constant is., Katheters die in de centrale veneuze circulatie zijn ingebracht en net boven de bovenste vena cava-rechter atriale kruising liggen, zijn grotendeels ontoereikend voor schuine bepalingen omdat bloed uit deze positie niet het beduidend onverzadigde bloed van de coronarysinus of inferieure vena cava zal bevatten.
bloedmonsters uit het rightatrium vertonen een significante variatie in het zuurstofgehalte als gevolg van het afsnijden van de bloedstroom en de beweging van de katheterpunt. Kathetertips in de rechterventrikel kan ventriculaire ectopie en opbrengst variabel zuurstofgehalte monsters veroorzaken., Gemengde veneuze monsters worden verkregen uit een longslagader katheter.
normale waarden zijn een gemiddelde partialedruk van O2 in gemengd veneus bloed van 40 mmHg(Svo2 75 %).
indien mogelijk, mag de patiënt niet worden gestimuleerd of gedurende enkele minuten voor de monstername worden onderbroken. Er moet op worden gelet dat luchtwegzuiging en andere procedures gedurende deze periode worden vermeden. Het arteriële en gemengde veneuze monster moet gelijktijdig worden getrokken. Er moet op worden gelet dat monsterfouten,met name van de longslagaderkatheter, worden vermeden.,
wanneer bloedmonsters uit de longslagader worden genomen, moet het monster langzaam worden afgenomen, omdat snelle aspiratie kan leiden tot vermenging van het longcapillaire bloed met het bloed van de longslagader, waardoor het zuurstofgehalte dramatisch toeneemt .
snelle doorstroming van intraveneuze fluidsvia een centrale veneuze katheter of meer proximale pa-katheterpoort kan bloed vervuilen dat uit de distale poort van de PA-katheter wordt getrokken en onjuiste hemoglobinebepalingen en zuurstofgehalteberekeningen veroorzaken.
De CaO2-en Cvo2-waarden worden berekend., Er mag niet meer dan 1 g/dlverschil zijn tussen het hemoglobinegehalte van de twee monsters. Een gemiddelde van de twee wordt aanbevolen voor de berekeningen als het verschil groter is dan 0,5 g/dL.
Het wordt aanbevolen om carboxyhemoglobine te meten of ervan uit te gaan dat het 1,5% is . De CO2-waarde wordt dan berekend met behulp van het gemiddelde of arteriële hemoglobinegehalte en aangenomen dat de partiële druk van O2 in het capillaire bed gelijk is aan de PaO2. Als de PaO2 groter is dan 150 mmHg, wordt aangenomen dat alle beschikbare hemoglobine onverzadigd is.
echte shunt is refractair voor zuurstoftherapie., Dit resulteert in whatis genoemd “refractaire hypoxemie”. Omdat refractaire hypoxemie niet reageert op zuurstoftherapie, moeten andere middelen worden gezocht om arteriële oxygenatie te verbeteren. Deze kunnen onder meer de behandeling van de onderliggende pathologie, toepassing van positieve End ExpiratoryPressure (PEEP) therapie of het verhogen van zuurstofgehalte te handhaven acceptabele zuurstoflevering.
de meest voorkomende oorzaken van refractoryhypoxemie zijn onderverdeeld in cardiale en pulmonale., De meest voorkomende pulmonale oorzaken zijn geconsolideerde pneumonitis, atelectasis, neoplasma, of de acute respiratory distress syndrome/acute lunginjury.
Shunt en PEEP
aangezien echte shunt niet reageert op zuurstof, kan een positieve expiratoire druk of PEEP-therapie worden toegepast op de zieke longen om QSP/QT te helpen verminderen. Onder de fysiologische reacties die met PEEP worden waargenomen, zijn verbeterde oxygenatie, verhoogde functionele restcapaciteit, verbeterde longcompliance en een afname in rangeren.,
de afname van rangeergedrag bij PEEPis het meest klassiek toegeschreven aan alveolaire werving of een toename van functionele restcapaciteit secundair aan de inflatie van eerder ingestorte alveoli . Gattinoni heeft met behulp van computertomografie de regionale gasdistributie in weefsels tijdens de titratie van PEEP beschreven . Deze studies hebben het klassieke buigpunt in de gas/weefselkromme bevestigd, die met alveolaire rekrutering verenigbaar is .
De respons van Peeptitratie varieert niet alleen met het type longpathologie, maar ook met het onderzochte longgebied., Meer afhankelijke long regio ‘sondergaan grotere mate van alveolaire rekrutering, terwijl minder afhankelijke long regio’ s hebben de neiging om grotere stijgingen inalveolaire volume ervaren zonder rekrutering, en regio ‘ s van Long die niet reageren op PEEP zijn gelijkelijk verdeeld over de long.
andere methoden om de oxygenatie te verbeteren,zijn onder meer de “prone positioning”, die de homogeniteit van het intrapulmonale proces verhoogt en de ventilatie verbetert .