inte alla kollisioner är lika
för en gas vid rumstemperatur och normalt atmosfärstryck finns det cirka 1033 kollisioner i varje kubikcentimeter utrymme varje sekund. Om varje kollision mellan två reaktantmolekyler gav produkter, skulle alla reaktioner vara fullständiga i en bråkdel av en sekund. Till exempel, när två biljardbollar kolliderar, studsar de helt enkelt av varandra., Detta är det mest sannolika resultatet om reaktionen mellan A och B kräver en signifikant störning eller omläggning av bindningarna mellan deras atomer. För att effektivt initiera en reaktion måste kollisioner vara tillräckligt energiska (eller ha tillräcklig kinetisk energi) för att åstadkomma detta obligationsavbrott. Detta diskuteras vidare nedan.
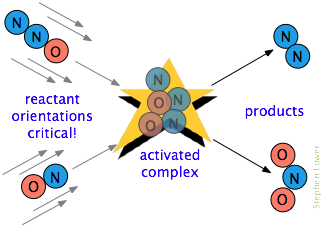
det finns ofta ett ytterligare krav. I många reaktioner, särskilt de som involverar mer komplexa molekyler, måste reaktionsarterna orienteras på ett sätt som är lämpligt för den specifika processen., Till exempel, i gasfasreaktionen av dikväveoxid med kväveoxid, måste syreänden av N2O slå kväveänden av NO; ändra orienteringen av endera molekylen förhindrar reaktionen. På grund av den omfattande randomiseringen av molekylära rörelser i en gas eller vätska finns det alltid tillräckligt med korrekt orienterade molekyler för några av molekylerna att reagera. Ju mer kritiskt detta orienteringskrav är desto färre kollisioner kommer att vara effektiva.,
energiska kollisioner mellan molekyler orsakar interatomiska bindningar att sträcka och böja, tillfälligt försvaga dem så att de blir mer mottagliga för klyvning. Förvrängning av obligationerna kan utsätta deras tillhörande elektronmoln för interaktioner med andra reaktanter som kan leda till bildandet av nya obligationer.,
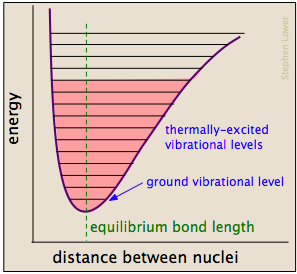
kemiska bindningar har några av egenskaperna hos mekaniska fjädrar: deras potentiella energier beror på i vilken utsträckning de sträcker sig eller komprimeras. Varje atom-till-atom-bindning kan beskrivas med ett potentiellt energidiagram som visar hur dess energi förändras med dess längd., När bindningen absorberar energi (antingen från uppvärmning eller genom en kollision) höjs den till ett högre kvantifierat vibrationstillstånd (indikerat av de horisontella linjerna) som försvagar bindningen eftersom dess längd oscillerar mellan de förlängda gränserna som motsvarar kurvan.
en viss kollision kommer vanligtvis att excitera ett antal bindningar på detta sätt. Inom ca 10-13 sekunder fördelas denna excitation bland de andra bindningarna i molekylen på komplexa och oförutsägbara sätt som kan koncentrera den tillsatta energin vid en särskilt sårbar punkt., Den drabbade bindningen kan sträcka och böja längre, vilket gör den mer mottaglig för klyvning. Även om bindningen inte bryts av ren sträckning kan den bli förvrängd eller vriden för att exponera närliggande elektronmoln för interaktioner med andra reaktanter som kan uppmuntra en reaktion.