elektronkonfiguration
elektronerna i en atom fyller upp sina atomiska orbitaler enligt Aufbau-principen; ”Aufbau” på tyska betyder ” uppbyggnad.”Aufbau-principen, som innehåller Pauli-Uteslutningsprincipen och hunds regel föreskriver några enkla regler för att bestämma i vilken ordning elektroner fyller atomiska orbitaler:
- elektroner fyller alltid orbitaler med lägre energi först. 1s fylls före 2s och 2s före 2P.,
- principen Pauli uteslutning anger inga två elektroner inom en viss atom kan ha identiska kvanttal. I funktion innebär denna princip att om två elektroner upptar samma orbital måste de ha motsatt spinn.
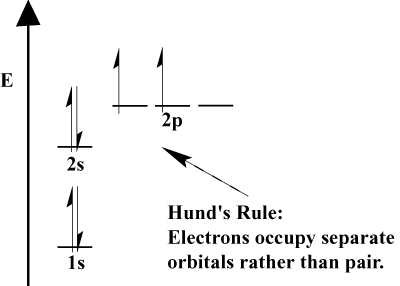
- hunds regel säger att när en elektron ansluter sig till en atom och måste välja mellan två eller flera orbitaler av samma energi, föredrar elektronen att gå in i en tom orbital snarare än en redan upptagen., När fler elektroner läggs till atomen tenderar dessa elektroner att halvfylla orbitaler av samma energi innan de parar sig med befintliga elektroner för att fylla orbitaler.
Valens-och valenselektroner
det yttersta orbitalskalet hos en atom kallas dess valenskalet, och elektronerna i valenskalet är valenselektroner. Valenselektroner är de högsta energielektroner i en atom och är därför den mest reaktiva. Medan inre elektroner (de som inte i valenskalet) vanligtvis inte deltar i kemisk bindning och reaktioner, kan valenselektroner vinnas, förloras eller delas för att bilda kemiska bindningar., Av denna anledning tenderar element med samma antal valenselektroner att ha liknande kemiska egenskaper, eftersom de tenderar att vinna, förlora eller dela valenselektroner på samma sätt. Det periodiska systemet utformades med denna funktion i åtanke. Varje element har ett antal valenselektroner lika med sitt gruppnummer på det periodiska bordet.
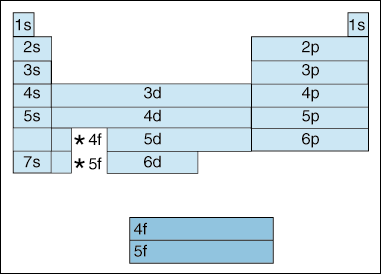
denna tabell visar ett antal intressanta och komplicerade egenskaper hos elektronkonfigurationen.,
först, när elektroner blir högre i energi, sker ett skift. Hittills har vi sagt att som principen quantum nummer, ökar, så gör energinivån i omloppsbanan. Och som vi nämnde ovan i Aufbau-principen fyller elektroner lägre energi orbitaler innan de fyller högre energi orbitaler. Diagrammet ovan visar dock tydligt att 4S orbital fylls före 3d-orbitalen., Med andra ord, när vi kommer till princip quantum nummer 3, de högsta underskalorna av de lägre kvanttal förmörkas i energi De lägsta underskalorna av högre kvanttal: 3d är av högre energi än 4s.
För det andra indikerar ovanstående en metod för att beskriva ett element enligt dess elektronkonfiguration. När du flyttar från vänster till höger över det periodiska bordet visar ovanstående diagram den ordning i vilken orbitaler fylls. Om vi var faktiskt bryta ner ovanstående diagram i grupper snarare än de Block vi har, det skulle visa hur exakt hur många elektroner varje element har., Till exempel beskrivs väte-elementet, som ligger i det översta vänstra hörnet av det periodiska bordet, som 1s1, med S som beskriver vilken orbital som innehåller elektroner och 1 som beskriver hur många elektroner som bor i den orbitalen. Litium, som finns i det periodiska systemet strax under väte, skulle beskrivas som 1s22s1. Elektronkonfigurationerna för de första tio elementen visas nedan (notera att valenselektronerna är elektronen i högsta energiskal, inte bara elektronerna i högsta energi subshell).,

oktettregeln
vår diskussion om valenselektronkonfigurationer leder oss till en av kardinalprinciperna för kemisk bindning, oktettregeln. Oktettregeln säger att atomer blirspeciellt stabil när deras valensskal får ett komplett komplement av valenselektroner. Till exempel, i ovan, Helium (He) och Neon (Ne) har yttre valensskal som är helt fyllda, så varken har en tendens att vinna eller förlora elektroner., Därför finns Helium och Neon, två av de så kallade ädelgaserna, i fri atomform och bildar vanligtvis inte kemiska bindningar med andra atomer.
de flesta element har dock inte ett fullständigt yttre skal och är för instabila för att existera som fria atomer. Istället försöker de fylla sina yttre elektronskal genom att bilda kemiska bindningar med andra atomer och därigenom uppnå Ädelgaskonfiguration. Ett element tenderar att ta den kortaste vägen för att uppnå Ädelgaskonfiguration, oavsett om det innebär att få eller förlora en elektron., Till exempel, natrium (Na), som har en enda elektron i dess yttre 3s orbital, kan förlora den elektronen för att uppnå elektronkonfigurationen av neon. Klor, med sju valenselektroner, kan få en elektron för att uppnå konfigurationen av argon. När två olika element har samma elektronkonfiguration kallas de isoelektroniska.
Diamagnetism och Paramagnetism
elektronkonfigurationen för en atom har också konsekvenser för dess beteende i förhållande till magnetfält. Sådant beteende är beroende av antalet elektroner som en atom har som är spin Parade., Kom ihåg att hunds regel och Pauli-Uteslutningsprincipen kombinerar för att diktera att en atoms orbitaler kommer att fylla hälften innan de börjar fylla helt och att när de fyller helt med två elektroner kommer de två elektronerna att ha motsatta spinn.
en atom med alla dess orbitaler fyllda, och därför alla dess elektroner parade med en elektron av motsatt spinn, kommer att påverkas mycket lite av magnetfält. Sådana atomer kallas diagmetiska. Omvänt har paramagnetiska atomer inte alla sina elektroner spin-Parade och påverkas av magnetfält., Det finns grader av paramagnetism, eftersom en atom kan ha en oparad elektron, eller det kan ha fyra.