4.2. Vasogent ödem
störningar i kärlrummet är bland de vanligaste orsakerna till interstitiellt ödem (vasogent ödem) och resultat från kapillär hypertoni eller hypoproteinemi. Kapillärtryck (Pc) bestäms av arteriellt (PA) och venöst (PV) tryck och förhållandet mellan pre – till postkapillära resistanser (RA/RV) som visas av ekvationen :
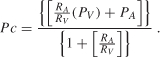
från ekvation (4.1) är det uppenbart att kapillärtrycket stiger när arteriellt eller venöst tryck ökar och/eller Pre – till postkapillärt motståndsförhållande faller. Eftersom arteriellt och venöst tryck och förhållandet pre-to-postcapillary resistens kan modifieras på en moment-to-moment basis i olika fysiologiska (t. ex., eller patologiska tillstånd (t.ex. inflammation) eller efter administrering av vasoaktiva läkemedel kan det förväntas att kapillärtrycket och därmed den transmikrovaskulära filtreringshastigheten snabbt kan öka i enlighet med dessa förändringar. Det har dock föreslagits att kapillärtrycket kan vara tätt reglerat som svar på förändringar i arteriellt eller venöst tryck, genom lämpliga justeringar i pre – eller postkapillär resistens, som ett medel för att upprätthålla en relativt konstant interstitiell vätskevolym när någon av dessa variabler förändras ., Till exempel, eftersom vaskulär glatt muskulatur i arteriella och arteriolära väggar kontraheras när de utsätts för förhöjt intravaskulärt tryck, ökar detta myogena svar prekapillär resistens och skyddar kapillärerna från en samtidig ökning av deras intravaskulära tryck. Omvänt, när artärtrycket faller, minskar MyoGen ton i arterioler, minskar deras motståndskraft mot flöde och upprätthåller kapillärtrycket. Dessa observationer tyder på att kapillärtrycket kan regleras över samma intervall av tryckförändringar över vilket flöde automatiskt regleras i ett givet organ., Faktum är att från förhållandet:

skulle man förutsäga att blodflödet (Q) reglering skulle vara perfekt kopplad till reglering av kapillärtryck, förutsatt att venöst tryck och motstånd förblir konstanta., En omfattande analys av förändringar i förhållandet mellan Pre-till-postkapillär resistens och kapillärtrycksförändringar indikerade emellertid att effektiviteten av flödes-och kapillärtrycksreglering inte alltid är nära korrelerad, en effekt som kan bero på passiva dimensionsjusteringar i kapillärer och venuler och reologiska förändringar i blodet som strömmar genom dessa kärl som arteriella tryckförändringar ., Förutom buffringseffekten av justeringar i förhållandet före till postkapillär resistens på kapillärtrycket minimeras påverkan av förändringar i kapillärtrycket inducerat av förändringar i perfusionstrycket genom direkt motsatta förändringar i kapillärfiltreringskoefficienten sekundärt till rekrytering eller derecruitment av perfuderade kapillärer .
på samma sätt buffras förändringar i kapillärtrycket och därmed kapillärfiltrering när venetrycket är förhöjt . Minst två mekanismer står för denna reglering av kapillärtrycket (figur 4.1)., Myogenic kontraktion av vaskulär glatt muskulatur i väggarna i arterioler framkallas genom överföring av det venösa trycket ökar till dessa uppströms fartyg . En venös-arteriolär reflex har också varit inblandad i detta svar, varvid höjningar i venöst tryck aktiverar antidromiska impulser som överförs till nervändar som påverkar uppströms arterioler, där neurotransmittorfrisättning framkallar förträngning . Det senaste arbetet har dock ifrågasatt vikten av denna mekanism jämfört med det myogena svaret ., Det är viktigt att notera att kapillärtrycket, och därmed kapillärfiltrering, inte är lika väl reglerat som svar på ökningar i venetryck eller motstånd som när arteriellt tryck förändras . Potentiella effekter av ökat venöst tryck för att minska kapillärfiltreringskoefficienten kan emellertid buffra svaret på förändrat kapillärtryck på transmikrovaskulär vätskerörelse, såsom beskrivits ovan.,
medan den ovan nämnda diskussionen fokuserade på effekten av akuta förändringar i venöst tryck på reglering av kapillärtryck och transmikrovaskulär vätskerörelse och gäller för de flesta organ, kan tunntarmen vaskulatur vara unik i sitt svar på kroniska förändringar i venöst tryck. Kronisk intestinal venös hypertoni inducerad av kalibrerad stenos i portvenen är associerad med utvecklingen av en hyperdynamisk cirkulation som kännetecknas av ökad hjärtminutvolym, minskad intestinal vaskulär resistens och ökat intestinalt blodflöde ., De senare förändringarna resulterar i en större ökning av tarmkapillärtrycket än vad som uppstår vid akuta venösa tryckhöjningar av samma storlek och är associerade med ökningar i kapillärfiltreringskoefficienten . Som en konsekvens är ökningen av transkapillärfiltrering mycket större vid kronisk kontra akut venös hypertoni., De mekanismer som är ansvariga för minskningen av intestinal vaskulär resistens som står för förändringarna i kapillärtrycket och kapillärfiltreringskoefficienten som leder till förbättrad kapillärfiltrering vid kronisk portalhypertension involverar bildandet av vasodilatormedel och andra faktorer och ses över någon annanstans .
kapillärtrycket ökar endast blygsamt (~2 mmHg) vid kronisk arteriell hypertension eftersom ökningen av arteriellt motstånd som orsakar ökningen av arteriella blodtrycksbuffertar överföring av trycket ökar till kapillärnivån ., Icke desto mindre, den tillhörande ökningen av transmikrovaskulär filtreringshastighet står till stor del för den förhöjda transkapillära flythastigheten av proteiner noterade i denna sjukdom genom konvektiv koppling av vätska och proteinflöde. Förhöjt kapillärtryck och filtreringshastighet uppträder tidigt under utvecklingen av diabetes mellitus och tros vara en viktig stimulans för kapillär basalmembranförtjockning, det ultrastrukturella kännetecknet för diabetisk mikroangiopati ., Mikrovaskulär sällsynthet eller förlust av kapillärer har rapporterats följa utvecklingen av arteriell hypertension, diabetes mellitus och det metaboliska syndromet . De åtföljande minskningarna i ytan som är tillgängliga för utbyte kan delvis kompensera effekten av kapillärhypertension för att öka interstitiell vätskevolym under dessa förhållanden.
mycket stora ökningar av venetrycket kan inducera ökningar i kapillärfiltrering långt över vad som skulle förutses från den tillhörande ökningen av kapillärtrycket., Detta beror på tryckinducerade ökningar i mikrovaskulär permeabilitet som manifesteras i Starling-ekvationen genom ökningar i hydraulisk konduktivitet och minskningar i den osmotiska reflektionskoefficienten., För de flesta organ permeabilitetsegenskaperna hos mikrovaskulära barriären för utbyte av vätska och lipid-olösliga lösningarna kan förklaras av förekomsten av ett stort antal små porer med radier på 70 angstroms eller mindre och ett mindre antal stora porer med radier över 200 angstroms, med vissa modeller som innehåller en tredje uppsättning mycket små porer (< 10 angstroms i radie) för att ta hänsyn till diffusionsflödet av vatten., (Organ som levern, som har diskontinuerliga kapillärer som kännetecknas av stora luckor mellan endotelceller och reflektionskoefficienter närmar sig 0,1, passar inte dessa modeller). Stora ökningar i venöst tryck tros förstora dessa porer i mikrovaskulär vägg, som kallas den sträckta pore fenomen . Enskilda organ visar en differentiell känslighet för effekten av förhöjt venöst tryck med avseende på induktion av sträckporefenomenet., Till exempel sker ingen ökning av permeabiliteten i mikrokärl av fötterna under tyst stående, även om kapillärtrycket i fötterna ökar med mer än 50 mmHg i förhållande till värden som mäts när liggande, på grund av den stora hydrostatiska kolonnen i artärer och vener. Lungkapillärer kan emellertid visa ett sträckt porfenomen under förhållanden som vänster ventrikelfel, en effekt som förvärrar lungödembildning i detta tillstånd .,
såsom noterats ovan är MyoGen förträngning av arterioler som svar på förhöjningar i arteriellt eller venöst tryck en viktig säkerhetsfaktor mot ödembildning i hydrostatiskt ödem genom att begränsa ökningen av kapillärtrycket och genom att minska antalet perfuderade kapillärer, och därmed den tillgängliga ytarean för vätskefiltrering, som annars kan uppstå som svar på arteriell eller venös hypertoni eller ökad venös resistens (figur 4.1)., Det är dock viktigt att notera även blygsamma steg i kapillärtrycket, vilket kan tyckas vara litet och inkonsekvent, kan leda till betydande ökningar i vätskefiltreringshastigheter över mikrovaskulaturen. Detta beror på att normalt nettofiltreringstryck är ganska litet, i genomsnitt 0,15 mmHg för en prototypisk kroppskapillär. Således ökar kapillärtrycket med bara 2 mmHg, som noterat ovan vid arteriell hypertension, resulterar i en initial 14-faldig ökning av vätskerörelsen från blodet till interstitium., Kapillär hypertoni resulterar i bildandet av ett proteinfattigt ultrafiltrat som vid inträde i det interstitiella utrymmet ökar interstitiell vätskevolym. På grund av interstitiumets överensstämmelse ger små steg i interstitiell volym mycket stora ökningar i vävnadstrycket, vilket effektivt minskar transkapillär hydrostatisk tryckgradient och därigenom begränsar ytterligare ackumulering av vätska (figur 4.1). Denna effekt förvärras som svar på höjningar i venöst utflödestryck genom fenomenet venös utbuktning., Det vill säga, ökar volymen i venerna omedelbart på förhöjning av venöst tryck, vilket ger en sammanfallande ökning av interstitiellt tryck som orsakas av expansion av engorged venoler och vener i interstitiella utrymmen (figur 4.1). I huvudsak skiftar venös engorgement den interstitiella överensstämmelsekurvan till vänster, så att en mindre förändring i interstitiell volym ger en större ökning av interstitiellt tryck. Ökat interstitiellt vätsketryck ökar lymfflödet med tre mekanismer., För det första ger ökat vävnadstryck drivtrycket för flöde till initiala lymfatik. För det andra skapar ökat tryck i det interstitiella facket radiell spänning på förankringsfilamenten som förbinder den extracellulära matrisen med lymfatiska endotelceller, lokalt ökande initial lymfatisk diameter och öppningsluckor mellan interdigiterande och överlappande korsningar mellan intilliggande lymfatiska endotelceller (figur 3.1)., Dessa dragkrafter skapar ett litet, övergående sug tryck för rörelse av interstitiell vätska genom förstorade luckor mellan intilliggande endotelceller, som fungerar som en andra, enkelriktad ventilsystem för att säkerställa enriktad flöde från interstitium till lymfatiska. För det tredje, när vätska rör sig in i initiala lymfatik, ökar volymen i uppströmslymfangioner, vilket främjar deras kontraktila aktivitet och lymfflöde. Närvaron av ventiler mellan intilliggande lymfangioner säkerställer envägsflöde.,
såsom noterats ovan, kapillär hypertoni resulterar i förflyttning av proteinfattig vätska i de interstitiella utrymmena, minska koncentrationen av vävnadsproteiner och minskande vävnad kolloid osmotiskt tryck (figur 4.1). Detta ökar effektiviteten hos den transkapillära onkotiska tryckgradienten (nc-nt) i motsats till den hydrostatiska gradienten (Pc − Pt) som gynnar filtrering., Eftersom lösnings utesluts från en stor del av gelvatten i den extracellulära matrisen, ökar snabbheten av minskningen av vävnadsproteinkoncentrationen som uppträder som svar på ökad interstitiell vätskevolym, vilket ökar effektiviteten av proteintvätt som en ödemsäkerhetsfaktor., Det är viktigt att notera att effektiviteten av minskningar i vävnads osmotiskt tryck som ett ödem säkerhetsfaktor reduceras i svår kapillär hypertoni, på grund av den sträckta-pore fenomen diskuteras ovan, vilket ökar konvektiv-kopplade protein transport in i vävnadsutrymmen.