introduktion
Fettderiverade stromala celler (asc) är multipotenta och immunoprivileged, vilket gör dem idealiska kandidater för terapeutiska ändamål (Bourin et al., 2013; Ma et al., 2014; Kallmeyer och peppar, 2015). Asc kan isoleras med hjälp av minimalt invasiva tekniker från olika fettvävnadsdepåer i kroppen (Zuk et al., 2001)., De kännetecknas av sin förmåga att hålla sig till plast, en unik ytmarkörprofil och förmågan att differentiera till ben, fett och brosk (Dominici et al., 2006; Bourin et al., 2013). Asc omfattar ~15-30% av den stromala vaskulära fraktionen (SVF) av fettvävnad (Bourin et al., 2013; Zuk, 2013), och måste utökas ex vivo för att erhålla tillräckliga celltal för terapeutiska ändamål.,
att tillhandahålla säkra och reglerade cellterapiprodukter till patienter kräver att god tillverkningssed (GMP) följs, och GMP-riktlinjer bör följas under hela processen att isolera, expandera och differentiera ASC (Giancola et al., 2012). De många reagenserna som används för att isolera och expandera ASC för forskningsändamål är animaliska härledda eller inte av klinisk kvalitet.därför måste dessa ersättas med mer lämpliga alternativ enligt GMP-standarder (Halme och Kessler, 2006; Riis et al., 2015)., Vi granskar valet av serumtillskott som kan användas för ASC-expansion i stället för fetalt bovint serum (FBS) och beskriver deras effekter in vitro och in vivo som rapporterats i litteraturen.,
International Society of cellterapi (ISCT) och Internationella Fett Tillämpad Teknik Samhälle (IFATS) Riktlinjer och Tekniker som Används för att Bedöma Fett som Härrör Stromal Cell Egenskaper
En minimal uppsättning av kriterier och riktlinjer har blivit rekommenderade av International Society of cellterapi (ISCT) och Internationella Fett Tillämpad Teknik Samhälle (IFATS) för karakterisering av Asc (Dominici et al., 2006; Bourin et al., 2013)., Dessa kriterier innefattar ASCs förmåga att hålla sig till plast, deras ytmarkörprofil och deras trilineagedifferentieringspotential. Det senaste positionsdokumentet beskriver viabilitet och spridning som ytterligare mätningar till de ursprungliga karakteriseringskriterierna. Dessutom har experimentella metoder och analyser definierats för att mäta karakteriseringskriterierna (Bourin et al., 2013)., Dessa kriterier har visat sig påverkas av många faktorer som fettsugningstekniken, SVF-isoleringstekniken och media och tillskott som används under expansionsprocessen (Koellensperger et al., Och med 2014. Bajek et al. År 2015; Busser et al., 2015). Enligt ISCT-och IFATS-riktlinjerna rekommenderas och accepteras forskningspraxis för att bekräfta överensstämmelse med ovanstående riktlinjer för varje isolering och kulturtillstånd för att klassificera den resulterande cellpopulationen som ASC.,
tekniker och metoder som används för att karakterisera ASC
morfologi och vidhäftning
när sådd, vidhäftande ASC visar en distinkt morfologi, som kan beskrivas som tunn, långsträckt och spindelformad. Den morfologiska bedömningen av ASC är vanligtvis förformad med hjälp av ljusmikroskopi (Trojahn Kølle et al., 2013).
Proliferation
riktlinjerna för ISCT och IFATS har rekommenderat att proliferationen och frekvensen av stamceller ACSs mäts med en fibroblastoidkolonibildande enhet (Bourin et al., 2013)., Andra tekniker som används i de studier som nämns i denna översyn använder sig av att räkna livskraftiga celler eller mäta den proliferativa kapaciteten hos ASCs med hjälp av immunohistokemi. Räkna metoder inkluderar (1) räkna celler med hjälp av en lönsamhet färgämne och en hemocytometer, (2) att räkna celler med hjälp av antingen räkna pärlor eller färgning tekniker och flödescytometrisk analys, och (3) använda färgläge analyser som mäter livskraftiga celler i en spektrofotometer (Gharibi och Hughes, 2012; Trojahn Kølle et al. 2013; för Bogdanova et al., Och med 2014. Atashi et al. År 2015; Johal et al. År 2015; Oikonomopoulos et al., 2015).,
Immunofenotyp
ISCT-och IFATS-riktlinjerna har listat uttrycket av flera ytmarkörer och deras förväntade procentsatser som ett fast krav i sin positionsbeskrivning. De har också rekommenderat att ytan markör uttryck bör mätas genom flerfärgade antikropp färgning (Bourin et al., 2013). Studier i denna översyn använde flödescytometrisk analys för att mäta ytmarköruttryck (Müller et al., 2006; Lindroos et al., 2009; Chieregato et al., 2011; Josh et al., 2012; Trojahn Kølle et al. 2013; för Bogdanova et al., Och med 2014. Patrikoski et al., 2014).,
Trilineage Differentiering
Differentiering i fett, ben, brosk och har traditionellt mätts med hjälp av histochemical färgningsteknik visualiseras under mikroskop, men ISCT och IFATS riktlinjer har rekommenderat att göra kvalitativa bedömningar bör ersättas eller kompletteras med kvantitativa metoder som mäter lineage-specifikt mRNA-uttryck som använder omvänd transkription kvantitativ polymeras chain reaction (RT-qPCR) tekniker (Bourin et al., 2013)., De tekniker som har använts för att mäta differentieringskapacitet, som beskrivs i de studier som nämns i denna översyn, har varierat från histokemisk färgning, till konventionell PCR och RT-qPCR. Histochemical färgningsteknik inkluderar färgning celler som antingen (1) olja röd O och nilen red för adipogenes; (2) Alizarin röd S, alkalisk fosfatas och von Kossa för osteogenesis; eller (3) Alcian blue och safranin för chondrogenesis (Müller et al., 2006; Kocaoemer et al., 2007; Hebert et al., 2010; Rajala et al., 2010; Koellensperger et al., Och med 2014. Oikonomopoulos et al. År 2015; Riis et al., 2016).,
Serumtillskott
fetalt bovint Serum
FBS är det traditionella serumtillskottet som används för cellkultur. FBS innehåller tillväxtfaktorer (GFs) och andra element som är väsentliga för ASC-fastsättning, expansion, underhåll och proliferation in vitro (Lennon et al., 1995, 1996; Zuk m.fl., 2001; van der Valk et al., 2010). FBS är benägen att batch-to-batch variation, xenoimmunisering, och eventuell förorening med mykoplasma, virus, endotoxiner och prioner (van der Valk et al., 2004, 2010; Chieregato et al., 2011; Kyllonen et al. 2013; för Jin et al., 2015)., Källan och kvaliteten på FBS kan påverka spridningen och differentieringen av ASC, och rutinmässig screening för mykoplasma, endotoxiner och virus har blivit viktig (Naaijkens et al., 2012). Dessa faktorer kan påverka experimentella resultat och göra cellprodukten osäker för klinisk användning (Zuk et al., 2001; van der Valk et al., 2004; Witzeneder et al., 2013).
asc är immunoprivilegerade och saknar uttryck för det stora histokompatibilitetskomplexet klass II samt T-och B-cellens costimulatoriska molekyler (CD80, CD86 och CD40)., Immunogeniciteten in vitro och immunosuppressiva egenskaperna hos ASC mäts vanligen genom samkultur av ASC med mononukleära celler i perifert blod i blandade lymfocytreaktioner och mätning av proliferativt T-cellsvar (McIntosh et al., 2006; Patrikoski m.fl., 2014). Asc visar immunmodulerande och immunosuppressiva egenskaper, vilket framgår av deras förmåga att reglera t-cellfunktionen och modulera cytokinsekretion in vitro och in vivo (Leto Barone et al. 2013; för Roemeling-van Rhijn et al. 2013; för Patrikoski et al., 2014)., Dessa egenskaper härrör från ASCs låga immunogenicitet. Majoriteten av ASC och andra mesenkymala stamceller (MSC) kliniska prövningar (fas I, II och III) använder FBS-kompletterade medier, och det har rapporterats att immunogena effekter framkallas av komponenter av FBS hos humana försökspersoner (Sundin et al., 2007; Riis m.fl., 2015). Till exempel, en klinisk studie med användning av benmärgs-härledda MSCs (BM-MSCs) expanderade I FBS fann antikroppar mot komponenter I FBS (Horwitz et al., 2002)., Immunsvar mot FBS såsom Arthus och anafylaktiska reaktioner har rapporterats i kliniska prövningar, där patienter behandlades med dendritiska celler och lymfocyter som exponerats för FBS (Selvaggi et al. 1997, Mackensen m.fl., 2000). Däremot fann en metaanalys av MSC kliniska prövningar att över 75% av experimenten använde FBS i sina cellutvidgningsprotokoll och endast en studie övervakade och demonstrerade biverkningar mot FBS (Lalu et al., 2012)., In vivo-studier som undersökte immunsvaret hos möss till ASC visade bevarad immunosuppression och immunmodulation, låg immunogenicitet och ingen reaktion på FBS (Cho et al., 2009; González et al., 2009). Även om ASC testas i stor utsträckning i kliniska prövningar återstår det att fastställa deras slutgiltiga användning som terapeutiskt medel. Detta förvärras ytterligare av användningen av prekliniska modeller som kanske inte är biologiskt relevanta (Monsarrat et al., 2016). Dessutom kan FBS vara mindre immunogent hos möss och andra djurmodeller än hos människor., Slutligen, immunsvaret framkallas av FBS (Selvaggi et al. 1997, Mackensen m.fl., 2000; Horwitz et al., 2002) kan möjligen påverka avstötningen av transplanterade celler i cellbaserad terapi.
Serumfria alternativ
den okända och odefinierade sammansättningen av FBS är en stor nackdel. Ett föredraget alternativ skulle vara ett kemiskt definierat medium med en känd sammansättning som kommersiellt tillgängliga serumfria (SF) eller XF media (Usta et al., 2014)., Dessa serumfria medier antas felaktigt sakna några animaliska produkter eftersom termerna SF och XF ofta används omväxlande. SF-media kompletteras emellertid vanligtvis med animaliskt härledd eller humant serumalbumin och GFs i odefinierade mängder (Patrikoski et al., 2013). Xeno – fria medier är å andra sidan kemiskt definierade medier som innehåller väldefinierade komponenter vid specifika koncentrationer (Usta et al., 2014).
tillväxtfaktorer
ett annat alternativ till serum är tillägg av GFs till odlingsmedium, antingen isolerat eller som en cocktail., Dessa GFs kan vara syntetiska, animaliska härledda eller mänskliga härledda. Byte med syntetiska GFs är att föredra på grund av deras högre kvalitet och som ett resultat av standardisering mellan satser, vilket kanske inte är möjligt för djur – eller mänskliga härledda GFs. Vanliga GFs är fibroblast tillväxtfaktor, epidermal tillväxtfaktor och trombocyt-härledd tillväxtfaktor (PDGF; Baer och Geiger, 2012; Ahearne et al., 2014). Tillägget av GFs har kopplats till en ökning av spridningen (Hebert et al., 2010; Gharibi och Hughes, 2012)., En förbättrad adipogen differentieringspotential har tidigare rapporterats i ASCs expanderat i GF-kompletterat medium (Hebert et al., 2010). En annan studie observerade emellertid en negativ effekt på adipogen och osteogen differentiering i långsiktiga odlade ASCs (Gharibi och Hughes, 2012).
serumalbumin
serumalbumin är ett rikligt plasmaprotein och kan isoleras från människor och djur. Ofta kompletteras SF-media med serumalbumin., Studier som jämför humant serumalbumin för ASC media-tillskott har funnit förbättrad proliferation, en mindre spindelliknande morfologi och bevarad differentiering till fett, ben och brosk (Rajala et al., 2010, Johal m.fl., 2015).
Kemiskt Definierade XF Medium
Xeno-fritt medium har rekommenderats som en ersättning för FBS och serum, eftersom det innehåller de komponenter som behövs för ASC expansion, inte innebär givare eller batch-till-batch-variant, är GMP-kompatibel och har minimal immunogenicitet och god immunsuppression (van der Valk et al., 2004, 2010; Usta m.fl.,, 2014). Jämfört med FBS har användningen av XF-medium för expansion av ASC lett till bättre morfologisk kvalitet, ökad proliferation, en jämförbar immunfenotyp och differentiering i fett, ben och brosk (Lindroos et al., 2009; Patrikoski et al., 2013; Oikonomopoulos m.fl., 2015). Användning av XF media i ASC expansion resulterar i Asc förlora deras förmåga att följa plast (Kyllonen et al. 2013; för Patrikoski et al., 2013; Oikonomopoulos m.fl., 2015). Ytterligare beläggningsmedel behövs för att bibehålla den inneboende egenskapen hos plast-vidhäftning i samband med ASC., Kommersiellt tillgängliga XF medium är dyrt och förbereda in-house XF medium kan vara tidskrävande och kan öka risken för batch-to-batch variation(Lund et al., 2009, Baer m.fl., 2010; Rajala et al., 2010, Yang m.fl., 2012; Kyllonen et al. 2013; för Patrikoski et al., 2013; Oikonomopoulos m.fl., 2015).
mänskliga alternativ
mänskliga alternativ kan ersätta FBS och SF / XF kompletterade media och kan skapa en kulturmiljö som mer exakt liknar den mänskliga miljön (Azouna et al., 2012; Koellensperger et al., 2014)., Vidare undanröjer användningen av autologa produkter (härledda från samma individ) behovet av testning för infektiösa och andra sjukdomsalstrande ämnen.
humant Serum
Efter att helblod har tillåtits koagulera i frånvaro av antikoagulant och har centrifugerats är serum den resulterande vätskedelen som inte innehåller blodplättar, vita blodkroppar eller röda blodkroppar (Figur 1; Stedman, 2006). Humant serum (HS) kan antingen vara autologt (donator och mottagare är samma individ) eller allogen (härledd från individer som skiljer sig från mottagaren)., Både autologa och allogena HS är överlägsen FBS (Stute et al., 2004; Bieback et al., 2009, 2012; Bernardo m.fl., 2011; Kyllonen et al. 2013; för Patrikoski et al., 2013). ASCs expanderade i HS har större transkriptomstabilitet än de expanderade I FBS, medan gener som är ansvariga för cellcykelförlängning, differentiering och extracellulär matris och prostaglandinsyntes uppregleras och överuttrycks I FBS jämfört med HS med hjälp av mikroarrayanalys (Shahdadfar et al., 2005)., Asc expanderade I FBS nådde senescence tidigare och visade telomere förkortning jämfört med ASC expanderade i HS (Shahdadfar et al., 2005). Valet av HS verkar ha liten effekt på ASCs immunmodulerande egenskaper. Asc expanderade i antingen allogena HS eller FBS innehållande media hade låg immunogenicitet och resulterade i immunosuppression (Patrikoski et al., 2014). Asc expanderade i antingen autolog eller allogen HS display större spridning och en omöjlig att skilja immunofenotyp jämfört med ASC expanderade I FBS (Josh et al., 2012; Bogdanova et al., 2014)., ASCs expanderade i allogen HS har differentierats till fett, ben och brosk, även om uppreglering av kondrogena och osteogena gener gynnades jämfört med FBS (Josh et al., 2012). ASCs expanderade i autologa HS har differentierats till fett och brosk; emellertid, förmågan att differentiera till ben var mindre gynnade (Bogdanova et al., 2014). Autologt HS kan ge ASC bättre proliferation och genomisk stabilitet enligt mikroarrayanalys jämfört med allogen HS (Shahdadfar et al., 2005; Bieback et al., 2009, Bernardo m.fl., 2011)., ASCs expanderade i allogeneic HS trädde tillväxt gripande och genomgick celldöd (Shahdadfar et al., 2005; Lindroos et al., 2009), som begränsar de potentiella fördelarna med allogen HS. Medan autologt HS kan vara idealiskt är tillgängligheten begränsad och det kan finnas signifikant variation mellan patienter i förmågan hos sitt eget serum för att stödja tillväxten av sina egna celler (Lange et al., 2007). Alternativt kan allogeneic HS Poolas, vilket ger större mängder för laboratorieexperiment och kan genomgå noggrann kvalitetskontroll av en blodbank (t. ex.,, testning för frånvaro av smittämnen och kontaminering med andra blodkroppar) före användning hos människor (Bieback et al., 2009).
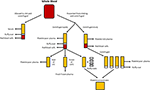
Figur 1. Produktion av de olika mänskliga alternativen. Serum produceras när helblod får koagulera och centrifugeras till pellets röda och vita blodkroppar och blodplättar. Plasma produceras genom förebyggande av koagulering följt av centrifugering., Beroende på centrifugeringshastigheten produceras antingen trombocytfattig plasma (PPP; snabb centrifugering) eller trombocytrik plasma (PRP; långsammare centrifugering). Om PPP lagras vid -18 ° C kallas det färskfryst plasma. Trombocytkoncentrat kan produceras antingen genom att ta blodplättsfattiga plasma-och 4 buffy-skikt och samla dem tillsammans eller centrifugera flera PRP: er och samla trombocytpellets (suspenderade i en liten mängd plasma) tillsammans.,
Plasma
Plasma är den icke-cellulära vätskedelen av blod som innehåller vatten, elektrolyter och proteiner (koagulationsfaktorer, fibrinogen och antikoagulantia). Platelet poor plasma (PPP), fresh frozen plasma (FFP) och platelet rich plasma (PRP; Figur 1) kan erhållas från helblod genom centrifugering vid olika hastigheter och efterföljande lagring vid olika temperaturer. FLICKVÄN sekretion kan förbättras genom att aktivera trombocyter i helblod med trombin före centrifugering (Doucet et al., 2005; Kocaoemer et al.,, 2007), vilket ökar plasmaprodukternas aktivitet.
blodplätt Dålig Plasma
PPP är nästan fri från blodplättar och produceras från helblod genom tillsats av ett antikoagulant under uppsamlingsprocessen, varefter plasman separeras med snabb centrifugering (Figur 1; Koellensperger et al., 2006). Detta gör det möjligt att pelletera blodplättar och röda blodkroppar. Den resulterande PPP lagras vid 4 ° C och kallas färsk plasma., PDGF utsöndras av de aggregerande blodplättarna; försumbar PDGF frigörs emellertid i PPP som ett resultat av det lilla antalet kvarvarande blodplättar. GFs kan därför behöva läggas till PPP när det används i media som är fallet vid användning av SF medium (Müller et al., 2006; Gottipamula et al., 2013). Användning av PPP utan tillsats av GFs har resulterat i lägre proliferationshastigheter och en mindre ökning av DNA-syntesen mätt med användning av tymidininkorporation, jämfört med HS och FBS (Vogel et al., 1980; Koellensperger m.fl., 2006)., PPP med extra GFs resulterade i ökade spridningshastigheter jämfört med HS (Koellensperger et al. Dessa skillnader kunde dock ha uppstått till följd av olika PRODUKTIONSPROTOKOLL för offentlig-privata partnerskap och tillägg av olika nivåer av offentlig-privata partnerskap till var och en av förberedelserna för offentlig-privata partnerskap i denna studie. Utbyggnaden av Asc i PPP resulterar i förbättrad spridning jämfört med FBS, och har osteogenic differentiering som är jämförbar med Asc expanderat i HS (Koellensperger et al., 2014)., Kondrogen differentiering minskade i ASC expanderade i PPP jämfört med ASC expanderade i PRP (Koellensperger et al., 2014).
färskfryst Plasma
FFP erhålls på samma sätt som PPP, men det fryses direkt efter separation vid -18°C (O ’ Shaughnessy et al., 2004; Liumbruno et al., 2009). FFP har använts vid utbyggnaden av BM-MSCs med positiva resultat., Dessa resultat inkluderar bättre proliferation, immunosuppressiv aktivitet och differentiering i adipocyter och osteocyter; och en immunofenotyp och morfologi som är jämförbar med celler expanderade I FBS (Müller et al., 2006; Mannello och Tonti, 2007). Användningen av FFP som serumsubstitut vid ASC-expansion kräver emellertid ytterligare undersökning.
Platelet Rich Plasma
PRP är den del av blod som är berikad med blodplättar. PRP produceras genom att separera plasma från röda blodkroppar vid långsammare centrifugeringshastigheter, vilket förhindrar pelletering av blodplättarna (Figur 1)., Asc expanderade i PRP upprätthålla en klassisk immunofenotyp och morfologi, och PRP ökar proliferation jämfört med FBS (Kocaoemer et al., 2007; Chieregato et al., 2011; Atashi et al., 2015). ASCs expanderade i PRP har förbättrat differentieringseffektivitet mot adipogena och osteogena lineages, samtidigt som den har jämförbar effektivitet för kondrogen differentiering, jämfört med ASCs expanderade I FBS (Kocaoemer et al., 2007; Chieregato et al., 2011). Vid jämförelse konstaterades HS vara något bättre än PRP när det gäller differentiering och spridning av ASC (Kocaoemer et al.,, 2007; Chieregato et al., 2011). PRP är ett dåligt definierat odlingsmediumtillskott på grund av dess höga biologiska variabilitet och komplicerade extraktionsförfarande, där rening av trombocytfaktorrika supernatanten från plasmamembran kan vara svårt. Användningen av PRP begränsas av de stora mängder helblod som behövs för att ge tillräckligt med PRP för experiment (Chieregato et al., 2011).,
Trombocytlysat
Human trombocytlysat (HPL) innehåller trombocyt GFs som erhålls genom att lysera blodplättar koncentrerade i en liten volym plasma (trombocytkoncentrat; Figur 1) genom temperaturchock. HPL innehåller en högre koncentration av GFs än andra serumet ersätter bland annat mänskliga PN och FBS (Doucet et al., 2005; Bernardo m.fl., 2006, 2011; Bieback et al., 2009; Schallmoser m.fl., 2010)., HPL kan lätt erhållas och framställas från aferes produkter och buffy rockar, och kan resuspenderas i antingen PRP eller en additiv lösning (Schallmoser och Strunk, 2013; Iudicone et al., 2014). HPL produceras genom frysning av blodplättar vid -30 och -80°C under 24 timmar, följt av upptining och centrifugeringssteg. De upprepade frysnings -, tina-och centrifugcyklerna möjliggör frisättning av GFs och avlägsnande av trombocytkroppar (Bernardo et al., 2006; Schallmoser m.fl., 2007)., En annan fördel med HPL-tillskott är att blodplättar kan användas efter 4-5 dagars utgångsdatum för bankat blod (Bieback et al., 2009). HPL är ett bättre alternativ än autologt och allogent HS, eftersom ASCs expanderade i HPL behåller sin klassiska immunofenotyp, differentiering, clonogen effektivitet, cellrenhet och cellviabilitet (Trojahn Kølle et al., 2013; Riis m.fl., 2016). HPL stöder också långsiktig expansion utan att äventyra ASCs immunmodulerande egenskaper, mätt genom flödescytometrisk analys (Bieback et al., 2009)., Expansion I HPL resulterar i en kortare populationsfördubblingstid, vilket minskar den tid som krävs för cellutvidgning och sänker hotet om senescence och transformation (Doucet et al., 2005; Shahdadfar et al., 2005; Bernardo m.fl., 2006, 2011; azouna m.fl., 2012). Biosäkerheten hos HPL har bedömts med hjälp av array jämförande genomisk hybridisering och högkänslig spektral karyotypning, där det konstaterades att ASCs expanderade i HPL inte hade några kromosomala avvikelser (Crespo-diaz et al., 2011; Trojahn Kølle et al., 2013)., Klassisk ASC morfologi (tunn, mindre, långsträckt och spindelformad) upprätthålls i HS och HPL, medan ASC expanderade I FBS är större och mindre spindelformade (Trojahn Kølle et al., 2013). Även om detta kan indikera att både HS och HPL väljer för primitiva/omogna ASC (Doucet et al., 2005; Bieback et al., 2009), Det föreslår också att celler som odlas i FBS har minskat proliferation och framsteg snabbare mot senescens. HPL varierar mellan individer (Bernard et al., 2006; Crespo-diaz et al., 2011), och batch-till-batch variation reduceras när HPL är gemensamma (Schallmoser et al.,, 2007; Trojahn Kølle et al., 2013). Dessutom, genom att samla många givare, kan en stor mängd erhållas för tillskott, vilket gör HPL att föredra framför PRP (Kocaoemer et al., 2007; Bieback m.fl., 2009; Chieregato et al., 2011).
slutsats
enligt Riis et al. av alla registrerade kliniska prövningar med utökade ASC som har listat sina expansionsförhållanden använder majoriteten av FBS, tre studier använder autologa HS, en studie använder PRP och en studie använder HPL (Riis et al., 2015)., Denna statistik är alarmerande, eftersom FBS har potential att överföra zoonotiska sjukdomar efter celltransplantation, och immunreaktioner mot FBS-komponenter har rapporterats (Selvaggi et al. 1997, Mackensen m.fl., 2000). FBS är en icke-GMP-kompatibel produkt, eftersom den påverkar säkerheten och effekten av den ASC-terapeutiska och måste därför bytas ut (van der Valk et al., 2004; Kyllonen et al. 2013; för Witzeneder et al., 2013). Detta har åtgärdats genom att ersätta FBS med kemiskt definierade mänskliga härledda alternativ., Byte från FBS till mänskliga alternativ eller XF / SF-media i regenerativ medicin har den viktiga fördelen att ASCs prolifererar mycket snabbare i den senare, vilket resulterar i ett större antal celler för transplantation på kortare tid. Den relativa överlägsenheten hos olika kulturmedier diskuteras dock fortfarande i stor utsträckning. Studier som jämför mer än ett odlingsmedium har rapporterat varierande resultat (Lange et al., 2007; Bernardo m.fl., 2011; Koellensperger et al., 2014; Riis et al., 2016). Koellensperger et al., jämfört trilineage differentiering av Asc expanderat i FBS, PN, PPP, och HS (Koellensperger et al., 2014). Deras resultat visade att varje odlingsmedium tillät differentiering i en eller flera lineages, men aldrig i alla tre lineages. När XF media, FBS och HPL kompletteras media jämfördes, Riis et al. fann att vissa subpopulationer uttryckte specifika ytmarkörer beroende på det använda odlingsmediet (Riis et al., 2016)., Studier som jämförde immunofenotypen av ASC expanderade I FBS och andra odlingsmedier, fann liten eller ingen skillnad i cellytan markör uttryck, oberoende av de studerade markörerna (Tabell 1). Sådddensitet, syrespänning, sammanflöde, dissociation och valet av basalmedia kan också påverka experimentella resultat (Sotiropoulou et al., 2006; Freshney, 2010; Bourin et al. 2013; för Inamdar och Inamdar, 2013, Feng et al., 2014; Riis et al., 2015)., Valet av odlingsmedium beror på nedströmsanvändningen av dessa celler (administrering av differentierade eller icke-differentierade ASC) och det tillstånd som behandlas. Dessutom bör immunogeniciteten hos det odlingsmedium som används för att expandera cellerna före klinisk användning betraktas som en parameter som kan påverka det kliniska resultatet. De flesta studier som jämför olika kulturmedier använde de kriterier som anges av ISCT och IFATS för att validera användningen av ett alternativ till FBS., De flesta av dessa studier undersöker ASC morfologi, proliferation, immunofenotyp och förmågan hos dessa celler att differentiera längs osteogena, kondrogena och adipogena lineages i olika odlingsmedier. Få studier har utforskat andra aspekter av ASC, såsom senescence, genetisk stabilitet, transkriptom, proteom, immunogenicitet, cytokinsekretion och cellcykel (Shahdadfar et al., 2005; Bieback et al., 2012). Även om ICT-och Ifat-kriterierna var ett försök att förena fältet när det gäller standardrutiner (Dominici et al., 2006; Bourin et al.,, 2013), Det finns ingen konsensus kring vilka egenskaper hos asc är relevanta för kliniska prövningar, vilket gör jämförelsen av olika kulturmedier praktiskt taget omöjlig. Även om dessa kriterier ger mätbara resultat för enkel jämförelse kan förändrade komponenter som används för expansion av ASC ha olika effekter på ASC-slutprodukternas säkerhet, effekt och reproducerbarhet. Att undersöka förändringar i transkriptom, proteom och sekretom av ASCs expanderade i olika kulturmedier är viktigt, liksom användningen av celler expanderade under olika förhållanden i lämpliga prekliniska modeller.,

tabell 1. Effekterna av de olika medie tillskott på ASC in vitro.
författare bidrag
CD conceptualized och utarbetade översynen, och godkände det slutliga manuskriptet. MP assisterade i konceptualiseringen av översynen, reviderade och godkände det slutliga manuskriptet. MSP assisterade i konceptualiseringen av översynen, redigerade och godkände det slutliga manuskriptet och höjde finansieringen för de berörda projekten. Alla författare har läst och godkänt det slutliga manuskriptet.,
Finansieringen
Denna forskning och offentliggörs är resultatet av finansiering som tillhandahålls av Medical Research Council i Sydafrika i termer av (a) MRC: s Flaggskepp Utmärkelser Projektet SAMRC-RFA-UFSP-01-2013/STAMCELLER samt (b) den Extramural Enhet för stamcellsforskning och Terapi. Sydafrikas nationella forskningsfond tillhandahöll också finansiering.
intressekonflikt uttalande
författarna förklarar att forskningen genomfördes i avsaknad av kommersiella eller finansiella relationer som kan tolkas som en potentiell intressekonflikt.,
bekräftelser
författarna vill tacka Dr.Cheryl Tosh för hennes redaktionella hjälp.
Chieregato, K., Castegnaro, S., Madeo, D., Astori, G., Pegoraro, M., och Rodeghiero, F. (2011). Epidermal tillväxtfaktor, grundläggande fibroblast tillväxtfaktor och trombocyt-härledd tillväxtfaktor-bb kan ersätta fetalt bovint serum och konkurrera med human blodplättrik plasma i ex vivo-expansionen av mesenkymala stromala celler härledda från fettvävnad. Cytoterapi 13, 933-943. doi: 10.3109/14653249.2011.,583232
PubMed Abstrakt | CrossRef Full Text | Google Scholar
Mannello, F., och Tonti, G. (2007). Kortfattad granskning: inga genombrott för mänsklig mesenkymala och embryonala stamcellskultur: konditionerat medium, matarskikt eller feederfritt; medium med fetalt kalvserum, humant serum eller berikat plasma; serumfritt, serumbyte nonconditioned medium eller ad hoc-formel? allt som glittrar är inte guld! Stamceller 25, 1603-1609. doi: 10.1634/stemcells.2007-0127
PubMed Abstrakt | CrossRef Full Text | Google Scholar
Selvaggi, T. A., Walker, R. E.,, och Fleisher, ta (1997). Utveckling av antikroppar mot fetalt kalvserum med arthusliknande reaktioner hos humana immunbristvirusinfekterade patienter som fått syngeneiska lymfocytinfusioner. Blod 89, 776-779.
PubMed Abstract/Google Scholar
Stedman, T. L. (2006). Stedmans medicinska ordbok. Philadelphia, PA: Lippincott Williams & Wilkins.
Google Scholar