hur fungerar en buffert?
en buffert kan motstå pH-förändring eftersom de två komponenterna (konjugatsyra och konjugatbas) båda är närvarande i märkbara mängder vid jämvikt och kan neutralisera små mängder av andra syror och baser (i form av H3O+ och OH -) när de tillsätts till lösningen. För att klargöra denna effekt kan vi överväga det enkla exemplet på en fluorvätesyra (HF) och natriumfluorid (NaF) buffert., Fluorvätesyra är en svag syra på grund av den starka attraktionen mellan de relativt små f – ion och solvated protoner (H3O+), vilket inte tillåter det att dissociera helt i vatten. Därför, om vi får HF i en vattenlösning, etablerar vi följande jämvikt med endast liten dissociation (Ka (HF) = 6, 6×10-4, starkt gynnar reaktanter):
\
Vi kan sedan tillsätta och lösa upp natriumfluorid i lösningen och blanda de två tills vi når önskad volym och pH vid vilket vi vill buffra., När natriumfluorid löses upp i vatten, går reaktionen till slut, så får vi:
\
eftersom Na+ är konjugat av en stark bas, kommer den inte att ha någon effekt på buffertens pH eller reaktivitet. Tillsatsen av \(NaF\) till lösningen kommer emellertid att öka koncentrationen av F-i buffertlösningen och följaktligen genom Le Chateliers princip leda till något mindre dissociation av HF i föregående jämvikt också. Närvaron av signifikanta mängder av både konjugatsyran, \(HF\) och konjugatbasen, F-, tillåter lösningen att fungera som en buffert., Denna buffertåtgärd kan ses i titreringskurvan för en buffertlösning.
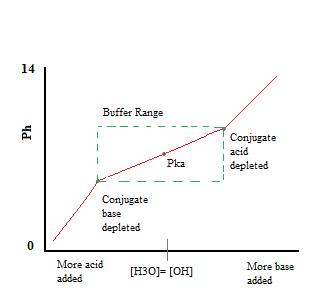
som vi kan se, över buffertens arbetsområde. pH förändras mycket lite med tillsats av syra eller bas. När buffertkapaciteten överskrids hoppar pH-förändringshastigheten snabbt. Detta beror på att konjugatsyran eller basen har uttömts genom neutralisering. Denna princip innebär att en större mängd konjugatsyra eller bas kommer att ha en större buffringskapacitet.,
om syra tillsattes:
\
i denna reaktion kommer den konjugerade basen, F-, att neutralisera den tillsatta syran, H3O+, och denna reaktion går till slut, eftersom reaktionen av F – med H3O+ har en jämviktskonstant som är mycket större än en. (I själva verket är jämviktskonstanten reaktionen som skrivet bara den inverse av Ka för HF: 1 / Ka(HF) = 1/(6.6×10-4) = 1.5×10+3.,) Så länge det finns mer F – än H3O+, kommer nästan alla H3O+ att konsumeras och jämvikten kommer att skiftas till höger, något öka koncentrationen av HF och något minska koncentrationen av F-, men resulterar i knappast någon förändring i mängden H3O+ närvarande när jämvikt återställs.,
om basen tillsattes:
\
i denna reaktion kommer konjugatsyran, HF, att neutralisera tillsatta mängder bas, OH-och jämvikten kommer igen att flyttas till höger, vilket ökar koncentrationen av F – i lösningen och minskar mängden HF något. Återigen, eftersom de flesta av OH – neutraliseras, kommer Liten pH-förändring att inträffa.
dessa två reaktioner kan fortsätta att alternera fram och tillbaka med liten pH-förändring.