järnoxid, även kallad av dess IUPAC namn järntrihydrat eller järn(III) oxid, är en oorganisk förening som representeras av den kemiska formeln Fe2O3 eller Fe2H6O3 . Det är en av de viktigaste oxiderna av järn, de andra två är ferrosoferrikoxid (Fe3O4) respektive järnoxid (FeO). Det förekommer naturligt som mineralhematiten .,
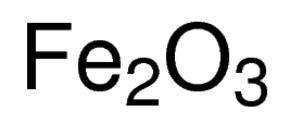
Ferrikoxidformel
hydrerad järnoxid
det är en rödbrun gelatinös förening som produceras vid tillsats av alkali till lösningar som innehåller Fe(III) salter. Det kallas också Hydro järnoxid och kan vara kemiskt representerade antingen som Fe2O3.H2O eller Fe(O)ÅH . Några vanliga former av den hydratiserade järnoxiden inkluderar röd lepidocrocit som uppträder externt i rustiklar och orange goethite som uppträder på insidan av rustiklar.,
hur framställs järnoxid
järnoxid syntetiseras i laboratoriet genom elektrolys av natriumbikarbonatlösning, som fungerar som en inert elektrolyt och en järnanod. Den elektrolytiska omvandlingen av järn till hydratiserat järn (III) oxid representeras som:
4FE + 3O2 + 2H2O → 4 FeO(OH)
den hydratiserade järnoxiden (III) som sålunda produceras genomgår uttorkning vid cirka 200 °C för att bilda järnoxid ., till ferrosulfat (FeSO4), som ytterligare oxideras till ferrisulfat :
- FeS2 + 7O+ H2o → FeSO4 + H2SO4
- 2FeSO4 + H2SO4 + O → Fe2(SO4)3 + H2O
aluminium ersätter järn från järnoxid
aluminium och järnoxid genomgår en redoxreaktion genom vilken metallen ersätter järn för att bilda Aluminium oxid:
Fe2O3 + 2AL → Al2O3 + 2FE
egenskaper och egenskaper hos järnoxid
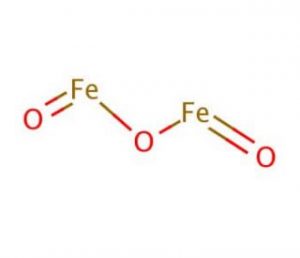
struktur av järnoxid
använder
- inom järnindustrin för framställning av stål och legeringar .,
- Järnoxidpulver, även kallat juvelerarens rouge, används för polering av linser och metalliska smycken .
- dess granulära form används som ett filtreringsmedium för att dra ut fosfater i saltvattensakvarier .
- som FDA-godkänd Pigment Brown 6 och Pigment Red 101, för användning i kosmetika .
- i biomedicinska tillämpningar, eftersom dess nanopartiklar är giftfria och biokompatibla .
är det farligt
långvarig exponering för dess rök eller damm kan leda till pneumokonios med feber, frossa, värk, andfåddhet och hosta ., Upprepad kontakt med ögonen kan missfärga det och orsaka permanent järnfärgning .
- järn (III – oxid-Chemspider.com
- järnoxid röd – Pubchem.ncbi.nlm.hih.gov
- magnetit (Fe3O4) – Pubchem.ncbi.nlm.nih.gov
- järnoxid – Pubchem.ncbi.nlm.nih.gov
- CHEBI: 50819-järnoxid – Ebi.ac.uk
- Järnoxidstoft och rök (som Fe) – Cdc.gov
- kinetik och mekanism för uttorkning av γ-FeOOH – Researchgate.net
- järn (III) Oxidpartiklar – Americanelements.com
- järnoxid – Chemicalbook.,com
- magnetiska egenskaper hos material – Sigmaaldrich.com
- järn (III – oxid-Chem.libretexts.org
- järnoxid (Fe2O3), hydrat (förening) – Pubchem.ncbi.nlm.nih.gov
- oxidationen av järnsulfat till järnsulfat med hjälp av luft – Archive.org
- användning av järnoxid – Zjunited.com
- farligt ämne faktablad järnoxid – Nj.gov