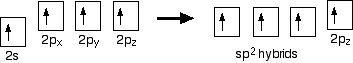en enkel vy av dubbla kovalenta bindningar
en dubbel kovalent bindning är där två par elektroner delas mellan atomerna snarare än bara ett par.
några enkla molekyler som innehåller dubbelbindningar
syre, O2
två syreatomer kan både uppnå stabila strukturer genom att dela två par elektroner som i diagrammet.
dubbelbindningen visas konventionellt av två linjer som förenar atomerna. Varje rad representerar ett par delade elektroner.,
koldioxid, CO2
eten, C2H4
eten har en dubbelbindning mellan de två kolatomerna.
en mer sofistikerad bild av bindningen i eten
det är viktigt att utforska bindningen i eten mer detalj eftersom den har en direkt inverkan på dess kemi. Om du inte har någon förståelse för den sanna karaktären av dubbelbindningen, kan du inte riktigt förstå hur eten beter sig.,
en orbital vy av bindningen i eten
eten är byggd från väteatomer (1s1) och kolatomer (1s22s22px12py1).
främjande av en elektron
kolatomen har inte tillräckligt med oparade elektroner för att bilda det önskade antalet bindningar, så det måste främja ett av 2S2-paret i den tomma 2PZ-orbitalen. Detta är exakt detsamma som händer när kol bildar bindningar-vad det än slutar med.
kolatomen är nu i ett upphetsat tillstånd.,
hybridisering
När det gäller eten är det en skillnad från metan eftersom varje kol endast ansluter sig till tre andra atomer i stället för fyra. När kolatomerna hybridiserar sina yttre orbitaler innan de bildar bindningar, hybriderar de bara tre av orbitalerna snarare än alla fyra. De använder 2s elektron och två av 2P elektroner, men lämnar den andra 2P elektron oförändrad.