en syra-bas (proton transfer) reaktion
för vårt första exempel på kemisk reaktivitet, låt oss titta på en mycket enkel reaktion som uppstår mellan hydroxidjon och saltsyra:
HCL+OH^- \Rightarrow H_20+Cl^-
detta är en syrabasreaktion: en proton överförs från HCL, syran, till hydroxid, basen. Produkten är vatten (den konjugatsyra av hydroxid) och kloridjon (den konjugerade basen av HCl)., Du har utan tvekan sett denna reaktion tidigare i allmän kemi. Trots sin enkelhet (och trots att reaktanterna och produkterna är oorganiska snarare än organiska), tillåter denna reaktion oss att för första gången överväga många av de grundläggande idéerna om organisk kemi som vi kommer att utforska i olika sammanhang i hela denna text.
nyckeln till att förstå bara om någon reaktionsmekanism är begreppet elektrondensitet, och hur den är ansluten till elektronrörelsen (bond-breaking och bond-forming) som uppstår i en reaktion., Hydroxidjonen – specifikt den elektronegativa syreatomen i hydroxidjonen-har hög elektrondensitet på grund av negativ laddning och polariteten hos väte-syrebindningen. Hydroxidsyret är elektronrikt.

väteatomen i HCl har å andra sidan låg elektrondensitet: den är elektronfattig. Som du kan förvänta dig är något som är elektronrik lockat till något som är elektronfattigt., Eftersom hydroxid och HCl rör sig närmare varandra lockas ett ensam par elektroner på det elektronrika hydroxidsyret av HCl-elektronfattig proton och elektronrörelsen sker mot proton. De två elektronerna i vätekloridbindningen sigma avstöts av denna annalkande hydroxidelektrondensitet, och därför rör sig ännu längre bort från proton och mot klorkärnan., Konsekvensen av all denna elektronrörelse är att väte-klorbindningen bryts, eftersom de två elektronerna från det bindningen helt bryter sig fri från väteets 1s-orbital och blir ett ensam par i 3P-orbitalen av en kloridanjon.
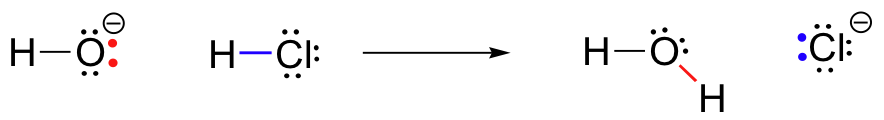
samtidigt som väte-klorbindningen bryts bildas en ny sigma-bindning mellan väte och syre, innehållande de två elektroner som tidigare var ett ensam par på hydroxid. Resultatet av denna bindningsbildning är naturligtvis en vattenmolekyl.
tidigare (avsnitt 6.1.,), vi såg hur böjda pilar användes för att skildra elektronrörelse som uppstår i kemiska reaktioner, där bindningar bryts och nya bindningar bildas. HCL + OH– reaktionen är till exempel avbildad genom att dra två böjda pilar.
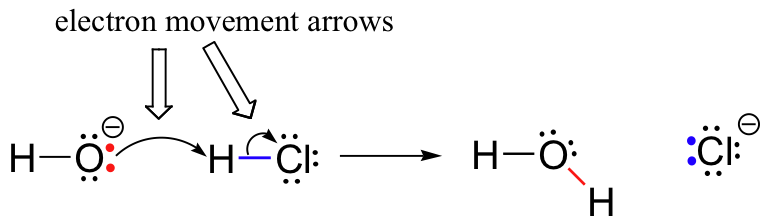
den första pilen har sitt ursprung vid ett av de ensamma paren på hydroxidsyret och pekar på H-symbolen i vätebromidmolekylen, vilket illustrerar ”attacken” hos det syrelösa paret och efterföljande bildning av den nya vätesyrebindningen., Den andra böjda pilen härstammar vid väte-brombindningen och pekar på ” Br ”– symbolen, vilket indikerar att detta band bryts-de två elektronerna ”lämnar” och blir ett ensamstående par på bromidjon.
det är mycket viktigt att betona vid denna tidpunkt att dessa krökta, två-taggiga pilar alltid representerar rörelsen hos två elektroner. Det mesta av denna bok kommer att ägnas åt beskrivningen av reaktionsmekanismer som involverar tvåelektronrörelse, så dessa fullhövdade pilar kommer att bli mycket bekanta.,

under andra terminen kommer vi dock att titta på radikala reaktionsmekanismer, där enelektronrörelse uppträder. För dessa processer kommer en krökt, enkelhake (”fish-hook”) pil att användas.
övning
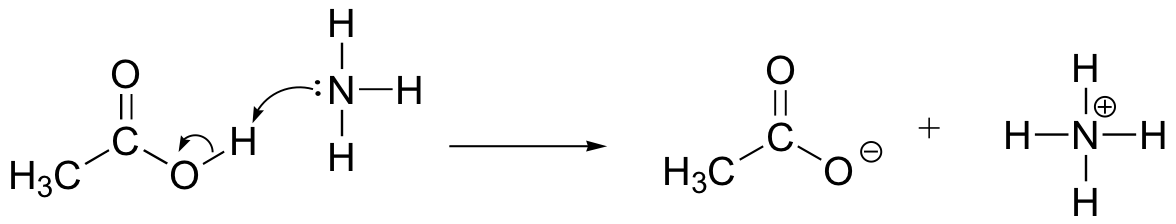
rita pilar för elektronrörelse för att illustrera syrabasreaktionen mellan ättiksyra, CH3COOH och ammoniak, NH3. Rita ut de fulla Lewis strukturerna av reaktanter och produkter.