introduktion
förståelsen och hanteringen av v/Q-relationer representerar acornerstone of intensive care unit (ICU) patienthantering. Förhållandet mellan v/Q (Fig. 1) kan ses som ett spektrum mellandeadspace (oändlig V/Q) och shunt (noll V/Q).
När pulmonärkapillärt blod utsätts för ett alveolärt partialtryck ofoxygen (PAO2) rör sig syremolekyler in iplasma som upplöst O2 och fortsätter att utöva en partielltryck.,
de flesta av dessa syremolekyler kombinerar omedelbart medhemoglobin och går in i ett tillstånd där de inte längre direkt utövar deltryck. Denna process fortsätter tills en partiell presregradient mellan alveolen och plasman inte längre existerar, vidvilken punkt hemoglobinet är maximalt mättat för blodpo2.
även om syret upplöst i plasmarenpresenterar endast 1,5% till 3% av det totala syret i blodet, är PO2-värdet viktigt eftersom det bestämmer drivkraften för syrerörelse in i och ut ur blodet.,
perfekt blodgasutbyte skulle kräva att varje alveolus ventilerasperfectly och allt blod som matas ut från höger ventrikel totraverse helt funktionella lungkapillärer. Dessutom måste diffusion över det alveolära/kapillära membranet hindras.
eftersom allt blod som passerar från höger kammare till vänster ventrikel skulle nå perfekt jämvikt med alveolargas, skulle den alveolära PO2 (PAO2) och den arteriella PO2 (PaO2) varaidentisk.
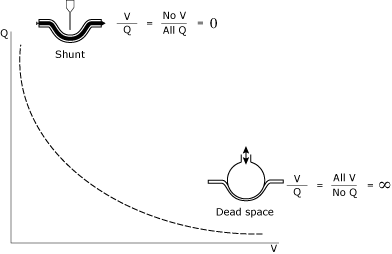
FIG. 1., Den matematiska och konceptuella illustrationen av shunt och deadspace.
som visas i Fig. 2, syresättning i normala lungor kanskiljer sig från den ideala situationen eftersom fördelningen av perfusionär ojämn.
relativt mer blodflöde förekommer iförvärvsberoende områden, och viss venös dränering (frånbronkiala, pleurala och Debesiska venerna) töms direkt in i den vänstra sidan av hjärtat, vilket kringgår (shunting) den normaloxygenationsmekanismen .,
på grund av detta kommer lite blod in iögon ventrikel med lägre syrehalt än blodetutbyte med en idealisk alveolus. Figur 3 representerar den resulterande lägre PaO2-nivån jämfört med den beräknade ideala syrespänningen.
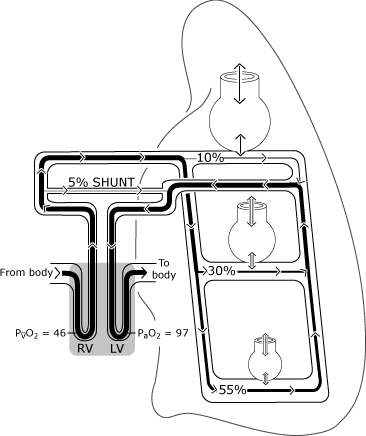
FIG. 2. Den normala lungan har ofullständig fördelning av ventilation och perfusion som primärt bestäms av gravitationen. Illustrationen förutsätter en upprätt hållning så att lungbaserna ligger i gravitationsberoende position., De icke-gravitationsberoende alveolerna är större, men får mindre gasutbyte (ventilation) än gravitationsberoende alveolerna. Fördelningen av perfusion styrs främst av gravitation med cirka 55% som strömmar till gravitationsberoende områden, 30% till mitten av lungområdena och 10% till de icke-gravitationsberoende lungområdena. PaO2 och PvO2 uttrycks i mmHg (kPa = mmHg × 0.133); RV = höger kammare; LV = vänster kammare. Reproduceras med tillstånd från Elsevier Health Sciences.
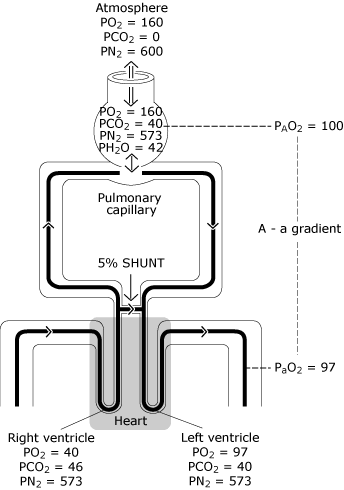
FIG. 3., Den normala lungan har ofullständig fördelning av ventilation, ofullkomlig fördelning av perfusion och viss minimal grad av intrapulmonell shunting. Resultatet är en minskning av PO2 från det beräknade ideala alveolära värdet (PAO2) till det uppmätta systemiska arteriella blodvärdet (PaO2). Denna PO2-skillnad är känd som” den alveolära till arteriella syrespänningsgradienten”. PO2 = syrespänning uttryckt i mmHg; pCO2 = koldioxidspänning uttryckt i mmHg; PN2 = kvävespänning uttryckt i mmHg; PH2O = vattenångspänning uttryckt i mmHg. (kPa = mmHg × 0.133)., Reproduceras med tillstånd från Elsevier Health Sciences.
Shunt och hypoxemi
anatomisk shunting definieras som blod som går från höger sidatill vänster sida av hjärtat utan att korsa pulmonärkapillärer. Kapillär shunting definieras som blod som går frånhjärtets högra sida till vänster sida av hjärtat viapulmonala kapillärer som ligger intill oventilerade alveoler.
båda fallen tillåter blod att komma in i vänstersidig cirkulation utanen ökning av syrehalten., Detta kallas noll V / Q, ellertrue shunting, eftersom blodet inte har haft möjlighet till gasutbyte med funktionella alveoler.
ett exempel på skakning i denkliniska inställningen är de gasutbytesavvikelser som ses inpneumoni genom frisättning av endotoxin som leder till cellulär ödem och vasokonstriktion .
Shunting och hypoxemi är inte synonyma termer, inte heller har de linjära relationer. Den hypoxemiska effekten av någon shunt kommer attberor inte bara på shuntens storlek utan även på syrestatus hos det venösa blodet som shunts (SVO2)., En liten shunt med en lågsvo2 kan ha djupa hypoxemiska effekter, medan en stor shunt med hög SvO2 kommer att orsaka mindre signifikant hypoxemi.
det kan otvetydigt sägas att när hypoxemi finns, måste vissagree av shunting (intrapulmonell eller intrakardiell) varapresent; emellertid beror effekten av shunt påpao2 kraftigt på kardiovaskulär funktion och metabolisk hastighet. Arteriell hypoxemi är ett resultat av lungfunktion, kardiovaskulär funktion och metabolism.,
bedömning avlungorna som oxygenator är nödvändig för att ta hand om många patienter som kräver kardiopulmonell understödjande vård. Beräkning avintrapulmonell shunting representerar det bästa tillgängliga sättet attdefiniera i vilken utsträckning lungsystemet bidrar tillhypoxemi.
intrapulmonell shunt
som tidigare angivits definieras den intrapulmonala shunten som denportion av hjärtutgången som kommer in i hjärtans vänstra sida utan att genomgå perfekt gasutbyte med helt funktionellalveoli. Intrapulmonell shunt kan delas in i trekomponenter.,
- anatomisk shunting har tidigare beskrivits som blod som kommer in i hjärtans vänstra sida utan att korsa lungkapillärer. Förutom normal anatomisk shunting från bronkial, pleural och Debesiska venerna kan anatomisk shunting ökas genom vaskulära lungtumörer och höger till vänster intrakardiella shuntar.
- kapillär shunting orsakas när blod passerar pulmonella kapillärer men inte jämvikt med alveolär gas på grund av patologiska processer såsom atelektas, lunginflammation och akut lungskada.,
- venös blandning uppträder när blodet jämnar med en alveolär PO2 som är mindre än idealisk som i situationer med låg V / Q . Eftersom venös blandning inte är sann shunt leder det ibland till förvirring. Summan av anatomiska och kapillära shuntar kallas oftast noll V / Q eller sann shunt. Venös blandning kallas ofta låg V / Q eller”shunteffekt”. Fysiologisk shunt i normala eller icke-sjuka lungor är en mätning av normal intrapulmonell shunt. Vid inställning av lungpatologi representerar fysiologisk shunt primärt svårighetsgraden av sjukdomstillståndet.,
shuntekvationen
ekvationen som används för att beräkna shuntedelen av hjärtutgången förutsätter att den icke-växlande gasen perfectlyoxygenater genom utbyte med perfekt alveolär gas.
även om detintrapulmonala shuntkonceptet inte återspeglar regionalarelationer, liksom ventilationsperfusionskonceptet, reflekterar det i vilken grad lungan avviker från idealet som anoxygenator av lungblod.
det är denna kvantitativa förmåga atttitta på lungorna som en oxygenator som gör denna mätningunik och värdefull i den kliniska miljön., Denna översyn använder theterm fysiologiska shunt med hänvisning till intrapulmonary shuntcalculated med patienten andas mindre än 100 % syre.
härledningen av shuntekvationen kommer från begreppen ofFick. År 1870 introducerade han det klassiska förhållandet att syrekvantiteten tillgänglig för vävnadsutnyttjande per tidsenhet innefattar den arteriella syrehalten (CaO2)multiplicerad med den mängd arteriellt blod som presenteras förfrågor per tidsenhet (dvs hjärtminutvolym, Qt).,
ekvation 1:
syre tillgängligt =(Qt)(CaO2)
syre tillbaka till lungorna inkluderar hjärtminutvolym(Qt) multiplicerat med den blandade venösa syrehalten(CVO2).
ekvation 2:
syre returneras =(Qt)(Cvo2)
syreförbrukning per tidsenhet (VO2) bör återspeglasyret som har extraherats från blodet under den tidenperiod.,
ekvation 3:
VO2 = (Qt)(CaO2)– (Qt)(CvO2)
ekvation 3 kan sedan skrivas om som det klassisktbeskrivs som Fick-ekvationen.
ekvation 4:
VO2 = Qt(CaO2 –CvO2)
Omarrangerat algebraiskt kan ekvation 4 uttryckas som enfunktion av hjärtutgången.,
ekvation 5:
Qt = VO2/(CaO2 –CvO2)(10)
för att uttrycka hjärtutgången i liter per minut måste oxygendifferensen vara
multiplicerad med en faktor på 10.
två andra ekvationer med vilka man måste bli bekant är denklassiska shuntekvationen (ekvation 6), som beskriver förhållandet mellan shunted hjärtminutvolym och total hjärtminutvolym(QS/Qt). Det mäts med patientenandning 100% syre.,
ekvation 6:
QS/Qt = (Cco2 –CaO2)/(Cco2 –CvO2)
den fysiologiska shuntekvationen (QSP / Qt) är ett annat sätt att uttrycka ekvation 6 när den mäts med patientenandning mindre än 100% syre och viss venös blandning finns.Därför är den fysiologiska shuntekvationen:
ekvation 7:
QSP/Qt = (Cco2 –CaO2)/ (Cco2 –CvO2)
QSP/Qt har fördelen av att varauppfattade som ett förhållande så att ingen absolut mått på hjärtutgången ärkrävs., I denna form visar ekvationen tydligt att somDen shuntade hjärtutgången närmar sig noll, den arteriella oxygeninnehållet måste närma sig det teoretiska slutet lungkapillaryoxygen-innehållet.
så länge någon del av hjärtminutvolymen inte utbyter perfekt med perfekta alveoler, måste den arteriella oxygencontententen vara mindre än den ideala änden lungkapillär oxygencontententen.
konsekvenserna av den fysiologiska shuntekvationen kan varabeceptualiserad genom att överväga syreinnehållet (cco2, CaO2, CvO2) som enheter som kan hällas i acontainer (Fig. 4)., Vissa faktorer, såsom hemoglobinkoncentration, kan påverka alla tre nivåerna.
Den mest importantclinical variabel som påverkar CcO2 isFiO2, medan både totalt hjärtminutvolym andoxygen konsumtion påverkar CvO2. Förändringar iden fysiologiska shunten påverkar CaO2.
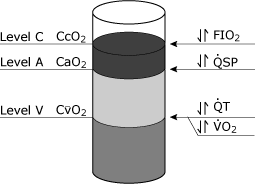
FIG. 4. Schematisk representation av blodets syrenivåer som teoretiskt kan erhållas från tre separata platser i hjärt-kärlsystemet. Nivå C representerar slutet pulmonell kapillär blod syrehalt (cco2)., Nivå a representerar den systemiska arteriella blod syrehalten (CaO2), och nivå V representerar den blandade venösa (lungartären) blod syrehalten (CvO2). De vanligaste kliniska variablerna som specifikt påverkar dessa olika nivåer visas: nivå C påverkas oftast av förändringar i FIO2( inspirerad syrefraktion), nivå a påverkas specifikt av förändringar i den fysiologiska shunten (QSP), nivå V påverkas specifikt av både den totala hjärtutgången (QT) och syreförbrukningen (VO2). Reproduceras med tillstånd från Elsevier Health Sciences.,
täljaren för shuntekvationen representeras avskillnader i cco2 andCaO2. Ekvationens nämnare ärrepresenteras av skillnaderna i cco2 ochcvo2.
förändringar av ojämn storlek blanddessa tre nivåer kommer att ändra förhållandet, vilket är ekvivalent med förändringar i den fysiologiska shuntberäkningen.
om en patient utvecklarfullminant höger-, mellan – och nedre lobkonsolidering, skulle arterial-och lungartärblodgasmätningarna avslöja aklinisk bild som återspeglas i Fig. 5.,
den arteriella oxygentensionen och innehållet minskas signifikant på grund av en storintrapulmonell shunt. Om hjärtproduktionen förblir oförändrad ochDen arteriella blandade venösa syreskillnaden förändras inte, dåkvo2 måste också minska.
På grund avförändring av ojämn storlek kommer den fysiologiska shunten stortöka sekundärt till hypoxemi.
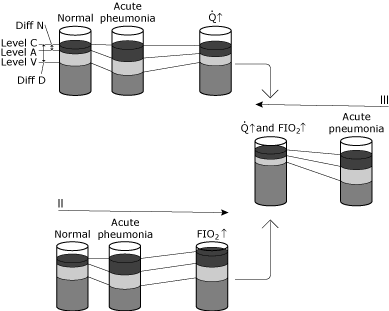
FIG. 5. Schematisk representation av förändringar i blodets syrenivåer under olika förhållanden., Syftet med denna illustration är att konceptualisera skillnaden mellan fysiologisk shunting och den hypoxemiska effekten av fysiologisk shunting. I, II och III illustrerar förändringar i en normal individ som kontraherar pneumonit som orsakar en signifikant ökning av intrapulmonell shunting utan någon kompensatorisk fysiologisk förändring., Statusen från normal till akut lunginflammation visar: ingen förändring i nivå C eftersom ventilation och FIO2 är oförändrade, en specifik minskning i nivå a på grund av ökad shunting skapad av lunginflammation och en minskning i nivå V eftersom av-innehållsskillnaden är oförändrad (hjärtproduktionen och syreförbrukningen oförändrad). Eftersom Diff N har ökat i högre grad än Diff D ökar den beräknade shunten. Tillstånd 1 visar en ökad hjärtminutvolym (qf) som svar på akut hypoxemi. Nivå C förblir oförändrad eftersom varken ventilation eller FIO2 har ändrats., Av-innehållsskillnaden har minskat eftersom hjärtproduktionen har ökat, medan syreförbrukningen förblir oförändrad. Ökningen i nivå V resulterar i en ny dynamisk jämvikt där Nivå A också ökas. Observera att förhållandet mellan Diff n och Diff D bara ändras något. Således har Nivå A (och därför PaO2) ökat med liten förändring i den beräknade shunten. I detta fall är kompensationen för hypoxemi kardiovaskulär; den intrapulmonala shunten har inte förändrats. Villkor II visar en ökad syrgaskoncentration (FIO2 trip)., Nivå C ökar, medan av-innehållsskillnaden förblir oförändrad (hjärtproduktionen och syreförbrukningen oförändrad). En ny dynamisk jämvikt resulterar i nivå a (och därmed PaO2 ökar). Förhållandet mellan Diff n och Diff D ändras bara något. Nivå a (och därför PaO2) har ökat med liten förändring i den beräknade shunten. I detta fall är ersättning för hypoxemi via syrebehandling; den intrapulmonala shunten är väsentligen oförändrad. Villkor III visar både hjärtminutvolym och inspirerade syrekoncentrationsförändringar (f.d. och f. d. FiO2)., Notera den djupa ökningen i nivå a (och därför PaO2) med liten förändring i Diff n/Diff D. reproduceras med tillstånd från Elsevier Health Sciences.
Allvarlig hypoxemi leder vanligtvis till en ökning av cardiacoutput. Detta resulterar i en minskning av den arteriella-venösa syreinnehållande skillnaden som återspeglas av en ökning inCvO2.
en ny jämvikt kommer att resultera i en ökning av CaO2 utan förändring i förhållande(QSP/Qt). De arteriella Po2förbättrar kraftigt, utan en signifikant förändring av fysiologisk shuntsekundär, på grund av en förbättrad hjärtproduktion.,
om antagandet görs att kompletterande syre administreras till denna patient medan hjärtminutvolymen förblir oförändrad, ökar CcO2 sekundärt till anökad alveolär PO2. Eftersom den fysiologiska shuntenförblir samma och den arteriella venösa syrehalten skiljer sig åtförblir densamma, en ny jämvikt resulterar icao2 och Cvo2ökande.
slutligen ändras omständigheterna för att skildra en patient medsyrebehandling och en ökning av hjärtproduktionen.CaO2 ökar eftersom bothCcO2 och CvO2 ökar.Hypoxemi förbättras medan förhållandet (QSP / QT) förblir oförändrat.,
den fysiologiska shuntberäkningen kan på ett tillförlitligt sätt återspegla graden av gasutbyte som kan hänföras till intrapulmonell sjukdom ellerintrakardiell växling oavsett andra faktorer som också kan spela en roll.
eftersom flera orsaker till hypoxemi ofta tas upp i de kritiskt sjuka, är förmågan att kvantifiera graden av intrapulmonell patofysiologi en extremt viktigverktyg.
hur man bestämmer shunt
den intrapulmonala shunten kan mätas endast närbåde arteriella och pulmonella arteriella blodprover är tillgängligaoch FIO2 är konstant., Katetrar infogade i den centrala venösa cirkulationen som ligger strax ovanför densuperior vena cava-höger atriell korsning är i stort sett otillräckliga för shuntbestämningar eftersom blod som dras från denna position inte kommer att innehålla signifikant desaturated blod från coronarysinus eller inferior vena cava.
blodprover tagna från rightatrium uppvisar signifikant variation av syrehalten på grund avkanalisering av blodflödet och kateterspetsens rörelse. Katetertips i höger kammare kan orsaka ventrikulär ektopi och yieldvariable syreinnehåll prover., Blandade venösa prover erhållsfrån en lungartärkateter.
normala värden är en genomsnittlig partielltryck av O2 i blandat venöst blod på 40 mmHg (SVO2 75 %).
om möjligt ska patienten inte stimuleras ellerstöras i flera minuter före provtagning. Försiktighet bör vidtas för att undvika luftvägsavsugning och andra procedurer under denna tidsperiod. Det arteriella och blandade venösa provet bör ritassamtidigt. Försiktighet måste vidtas för att undvika provtagningsfel, särskilt från lungartärkatetern.,
När blodprover tas från lungartären måste provet dras långsamt eftersom snabb aspiration kan leda till att pulmonell kapillärblod blandas med lungartärblod, vilket orsakar dramatiskaökningar i syrehalten .
det Snabba flödet av intravenös fluidsvia en central venös kateter eller mer proximala PA-kateter portscan förorena blod dras från den distala port PA catheterand orsaka felaktiga hemoglobin bestämningar och syre contentcalculations.
Cao2-och Cvo2-värdena beräknas., Det bör inte finnas mer än 1 g/dldifferens mellan hemoglobininnehållet i de två proverna. Genomsnitt av de två rekommenderas för beräkningarna omskillnaden är mer än 0,5 g / dL.
det rekommenderas attkarboxihemoglobin mäts eller antas vara 1,5 % . CO2-värdet beräknas sedan genom att använda genomsnittligt eller arteriellt hemoglobininnehåll och förutsatt att det partiella trycket av O2 i kapillärbädden är lika medpao2. Om PaO2 ärstörre än 150 mmHg, antas allt tillgängligt hemoglobin varamättad.
sann shunt är eldfast mot syrebehandling., Detta resulterar i vadbetecknas ”eldfast hypoxemi”. Eftersom eldfast hypoxemi inte svarar på syrebehandling, bör andra medel försökasförbättra arteriell syresättning. Dessa kan innefatta behandling avunderliggande patologi, tillämpning av positiv End ExpiratoryPressure (PEEP) terapi eller öka syrehalten för att upprätthållaacceptabel syretillförsel.
de vanligaste orsakerna till refraktoryhypoxemi är uppdelade i hjärt-och lung., De vanligastepulmonell orsaker är konsoliderad pneumonit,atelektas, neoplasma eller akut respiratorisk nödsyndrom/akut lunginjury.
Shunt och PEEP
eftersom sann shunt inte svarar på syre, kan positivt expiratoriskt tryck eller PEEP-terapi appliceras på de avbrutna lungorna för att bidra till att minska QSP / QT. Bland de fysiologiska svar som ses med PEEP är förbättrad syresättning, ökad funktionell kvarvarande kapacitet, förbättrad lungkompatibilitet och en minskning av bytet.,
minskningen av bytet som ses med PEEPis mest klassiskt hänförlig till alveolär rekrytering eller en ökning av funktionell återstående kapacitet sekundär till inflationen av tidigare kollapsade alveoler .
Gattinoni har beskrivit datortomografi den regionala gasdistributionen i vävnaderunder titreringen av PEEP . Dessa studier har bekräftat den klassiska inflektionspunkten i gas – / vävnadskurvan, vilket är förenligt med alveolär rekrytering .
svaret på Peeptitrering varierar inte bara med typen av lungpatologi utan ocksåmed regionen av lunga studerad., Mer beroende lungregioner ger större grad av alveolär rekrytering medan mindre beroende lungregioner tenderar att uppleva större ökningar ialveolär volym utan rekrytering, och regioner av lunga som inte är mottagliga för PEEP fördelas lika i hela lungan.
andra metoder för att förbättra syresättningen inkluderar benägen positionering,vilket ökar homogeniteten hos den intrapulmonala processen och förbättrar ventilationen .