definiția formală a unui gradient de concentrație este procesul de particule, care sunt uneori numite substanțe dizolvate, se deplasează printr-o soluție sau gaz dintr-o zonă cu un număr mai mare de particule într-o zonă cu un număr mai mic de particule. Zonele sunt de obicei separate printr-o membrană. Această membrană poate fi permeabilă, semi-permeabilă sau nepermeabilă., Permeabil este definit ca o membrană care poate fi traversată de particule, ioni sau apă. Semi-permeabil înseamnă că unele particule, ioni sau apă pot traversa membrana. În cele din urmă, o membrană nepermeabilă înseamnă că niciun fel de particule, ioni sau apă nu pot traversa membrana.
un exemplu care ar putea ajuta să înțelegeți diferitele tipuri de membrane ar fi diferite tipuri de garduri. Un gard din lemn ar permite trecerea multor lucruri – acesta ar fi un exemplu de membrană permeabilă., Un gard cu lanț ar permite unor obiecte mici să treacă prin el – aceasta ar fi ca o membrană semi-permeabilă. Un gard solid din plastic nu ar permite ca obiectele să treacă prin el deloc – aceasta ar reprezenta o membrană nepermeabilă.

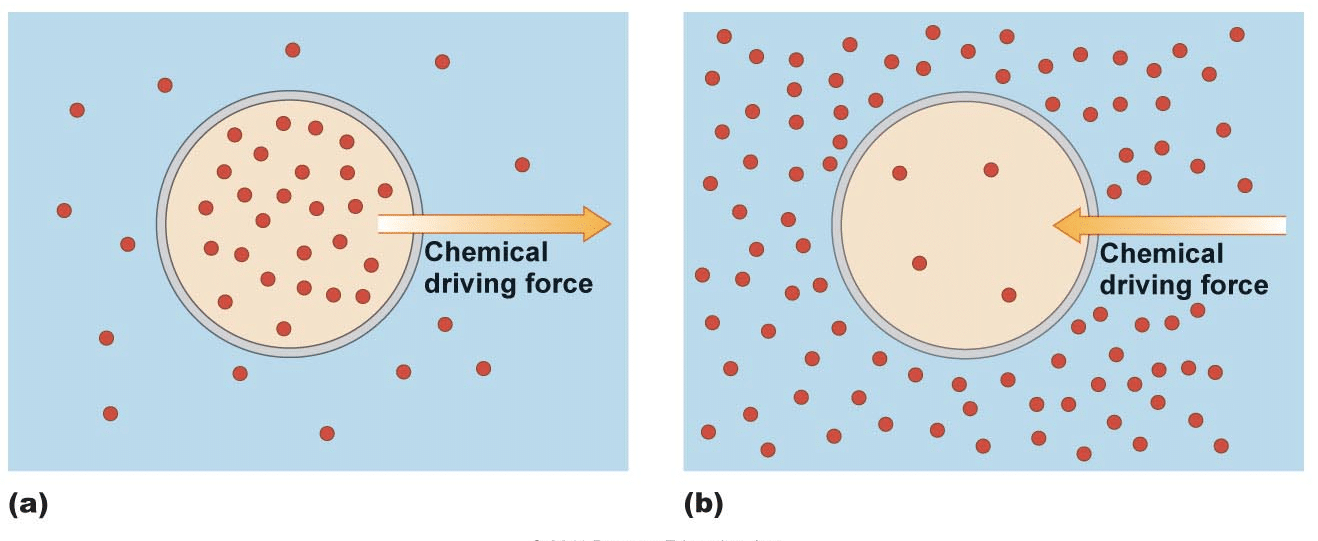
funcția de Concentrare Degradeuri
Concentrația degradeuri sunt o consecință firească a legilor fizicii., Cu toate acestea, lucrurile vii au găsit multe modalități de a-și folosi proprietățile pentru a îndeplini funcții importante de viață. Organismele care trebuie să mute o substanță în sau din celulele lor, de exemplu, pot utiliza mișcarea unei substanțe în jos gradientul său de concentrație pentru a transporta o altă substanță în tandem.
organismele pot utiliza, de asemenea, gradienți de concentrație pentru a realiza schimbări sau mișcări bruște prin eliberarea unor concentrații mari de solut pentru a se deplasa în zone cu concentrație scăzută. Neuronii sunt un exemplu de celule care utilizează concentrații mari de soluții pentru a realiza schimbări rapide.,
Exemple de zi cu Zi de Gradientul de Concentrație
concentrația de parfum molecule este mai mare pe zonele de piele care au avut parfum sau aftershave-ul direct aplicate. Alții pot mirosi mirosul, deoarece unele dintre aceste molecule sunt întotdeauna călătoresc departe de persoana parfumată, sursa, în aer-se deplasează în jos gradientul de concentrație, de la o concentrație mare la o concentrație mai mică. În cele din urmă, moleculele de miros sunt atât de dispersate încât nu mai pot fi detectate.,
gândiți-vă la mirosul neplăcut de miros de sconcs, când un sconcs a pulverizat sau a fost lovit de un vehicul. Pe măsură ce o persoană se apropie de sursa mirosului sconcs, mirosul devine mai puternic, deoarece „moleculele de miros” sunt mai concentrate mai aproape de sursă.
Molecule nu numai să călătorească prin aer, ci prin intermediul altor media, precum și., Atunci când o persoană pune creamer în cafeaua lui sau a ei, moleculele de cremă ar sări în cele din urmă în jurul în ceașcă, se deplasează în jos gradientul de concentrație până când distribuite uniform. Cu toate acestea, majoritatea consumatorilor de cafea nu așteaptă să se întâmple acest lucru. Acestea introduc energie suplimentară prin amestecarea cafelei și accelerarea procesului.
concentrația gradientului definiție Biologie
în biologia celulară, difuzia este o formă principală de transport pentru materialele necesare, cum ar fi aminoacizii din celule., Difuzia solvenților, cum ar fi apa, printr-o membrană semipermeabilă, este clasificată ca osmoză.
metabolismul și respirația se bazează parțial pe difuzie în plus față de procesele în vrac sau active. De exemplu, în alveolele plămânilor mamiferelor, datorită diferențelor de presiune parțială pe membrana alveolar-capilară, oxigenul difuzează în sânge și dioxidul de carbon difuzează. Plămânii conțin o suprafață mare pentru a facilita acest proces de schimb de gaze.
ce legătură are un Gradient de concentrare cu o plimbare aleatorie?,
amintiți-vă de mers aleatoriu părtinitoare? Ei bine, există întotdeauna un motiv pentru părtinire. Bacteriile își pot înclina plimbările pe baza gradientului de concentrație al unei anumite substanțe chimice. Deci, chiar dacă fiecare pas este într-o direcție aleatorie, lungimea pasului este mai lungă dacă bacteria se îndreaptă spre o concentrație mai mare decât dacă bacteria se îndreaptă spre o concentrație mai mică.
să urmărim din nou videoclipul aleatoriu părtinitor, de data aceasta cu gradientul de concentrare în fundal. Acum Puteți vedea motivul părtinirii în plimbare!,
Cum pot spune bacteriile dacă se îndreaptă spre o concentrație mai mare sau mai mică?
când o bacterie caută un anumit semnal chimic, detectează această substanță chimică în timp ce se mișcă de-a lungul căii sale. Dacă se deplasează în sus gradientul de concentrație, va începe să detecteze moleculele chimice din ce în ce mai frecvent. Dacă se deplasează în jos gradientul de concentrație, va începe să detecteze moleculele chimice din ce în ce mai rar. Aceasta determină în cele din urmă direcția și puterea părtinirii în mersul său aleatoriu.,
sistem de non-echilibru
deoarece difuzia chimică este un proces de transport net, sistemul în care are loc nu este un sistem de echilibru (adică nu este încă în repaus). Multe rezultate în termodinamica clasică nu sunt ușor de aplicat sistemelor de neechilibrare. Cu toate acestea, uneori apar așa-numitele stări cvasi-constante, unde procesul de difuzie nu se schimbă în timp, unde rezultatele clasice se pot aplica local. După cum sugerează și numele, acest proces nu este un adevărat echilibru, deoarece sistemul încă evoluează.,
Non-echilibru lichid sisteme poate fi modelat cu succes cu Landau-Lifshitz fluctuante hidrodinamică. În acest cadru teoretic, difuzia se datorează fluctuațiilor ale căror dimensiuni variază de la scara moleculară la scara macroscopică.
difuzia chimică crește entropia unui sistem, adică difuzia este un proces spontan și ireversibil., Particulele se pot răspândi prin difuzie, dar nu se vor reordona spontan (modificări absente ale sistemului, presupunând că nu se creează noi legături chimice și forțe externe absente care acționează asupra particulei).
Citește și: calculator antiderivativ-o scurtă introducere