muodollinen määritelmä pitoisuus kaltevuus on prosessi, jossa hiukkaset, jotka ovat joskus kutsutaan liuenneet aineet liikkuvat ratkaisun kautta tai kaasun alue, jossa on suurempi määrä hiukkasia alue, jossa pienempi määrä hiukkasia. Alueet erotetaan tyypillisesti kalvolla. Tämä kalvo voi olla läpäisevä, puoliläpäisevä tai läpäisemätön., Läpäisevä määritellään kalvoksi, jonka läpi voi kulkea hiukkasia, ioneja tai vettä. Puoliläpäisevä tarkoittaa, että osa hiukkasista, ioneista tai vedestä voi ylittää kalvon. Läpäisemätön kalvo tarkoittaa lopulta sitä, että yksikään hiukkanen, ioni tai vesi ei voi ylittää kalvoa.
esimerkki, joka voi auttaa sinua ymmärtämään erilaisia kalvoja olisi eri tyyppisiä aidat. Puinen log aita mahdollistaisi monia asioita läpi – tämä olisi esimerkki läpäisevä kalvo., Ketjun linkki aita antaisi joitakin pieniä kohteita läpi, se olisi kuin puoliläpäisevä kalvo. Kiinteä muoviaita ei antaisi esineiden kulkea sen läpi lainkaan – tämä edustaisi läpäisemätöntä kalvoa.

toiminto Pitoisuus Kaltevuudet
Pitoisuus kaltevuudet ovat luonnollinen seuraus fysiikan lakeja., Elolliset ovat kuitenkin löytäneet monia tapoja käyttää ominaisuuksiaan tärkeiden elintoimintojen suorittamiseen. Organismeja, jotka täytyy siirtää aineen tai ulos niiden solujen, esimerkiksi, voi käyttää liikkeen yksi aine, sen pitoisuus kaltevuus liikenteen toisen aineen rinnalla.
Organismit voivat myös käyttää pitoisuus kaltevuudet saavuttaa äkillisiä muutoksia tai liikkeitä vapauttamalla suuria pitoisuuksia liuenneen aineen siirtyä matalan pitoisuuden alueilla. Neuronit ovat esimerkki soluista, jotka käyttävät suuria määriä solukkoa nopeiden muutosten aikaansaamiseksi.,
Arjen Esimerkkejä Pitoisuus Kaltevuus
pitoisuus tuoksu-molekyylejä on korkein alueilla ihon, joka on ollut hajuvettä tai partavettä suoraan soveltaa. Muut voi haistaa tuoksu, koska jotkut niistä molekyylit ovat aina matkustaa pois tuoksuva henkilö, lähde, ulos ilmaan—liikkuvat alaspäin pitoisuus kaltevuus, korkea pitoisuus pienempi pitoisuus. Lopulta hajumolekyylit ovat niin hajallaan, ettei niitä enää voida havaita.,
Ajattele epämiellyttävä tuoksu haisunäätä haisee, kun haisunäätä on ruiskutettava tai ollut auto törmäsi. Kun ihminen pääsee lähemmäksi haisunäädän hajua, tuoksu voimistuu, koska” hajumolekyylit ” ovat voimakkaammin keskittyneet lähemmäs lähdettä.
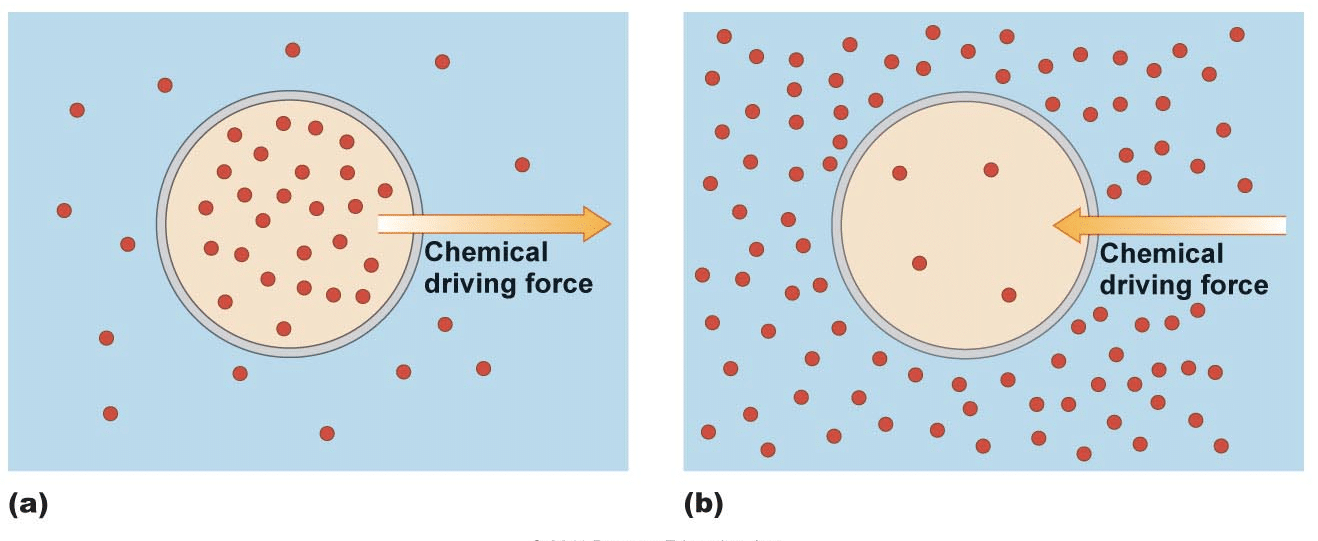
Molekyylejä, ei vain matkustaa ilmassa, mutta muissa tiedotusvälineissä samoin., Kun henkilö tuo kermakko hänen tai hänen kahvia, kerma molekyylejä lopulta pomppia ympäri cup, liikkuvat alas pitoisuus kaltevuus, kunnes tasaisesti jakautunut. Useimmat kahvinjuojat eivät kuitenkaan odota tämän tapahtuvan. Ne tuovat lisäenergiaa sekoittamalla kahvia ja nopeuttamalla prosessia.
Konsentraatio Gradientin Määritelmä Biologian
solun biologia, diffuusio on tärkein kuljetusmuoto tarvittavat materiaalit, kuten aminohappoja solujen sisällä., Liuottimien, kuten veden, diffuusio puoliperäisen kalvon läpi luokitellaan osmoosiksi.
Aineenvaihduntaa ja hengitystä luottaa osittain, kun diffuusio lisäksi irtotavarana tai aktiivisia prosesseja. Esimerkiksi keuhkorakkuloihin nisäkkäiden keuhkot, koska erot osittainen paineet koko keuhkorakkuloiden-kapillaari kalvo, happi diffundoituu verenkiertoon ja hiilidioksidi diffundoituu ulos. Keuhkoissa on suuri pinta-ala tämän kaasunvaihdon helpottamiseksi.
miten pitoisuusgradientti liittyy satunnaiseen kävelyyn?,
Muistatko puolueellisen satunnaiskävelyn? Puolueellisuuteen on aina syynsä. Bakteerit voivat harhauttaa kävelynsä tietyn kemikaalin pitoisuusgradientin perusteella. Joten vaikka jokainen vaihe on satunnainen suunta, pituus askel on pidempi, jos bakteeri on siirtymässä kohti suurempaa pitoisuutta kuin se on, jos bakteeri liikkuu kohti pienempää pitoisuutta.
katsotaan puolueellinen random walk video taas, tällä kertaa pitoisuus kaltevuus tausta. Nyt näet syyn harhaan kävelyssä!,
miten bakteerit voivat kertoa, liikkuvatko ne kohti korkeampaa vai pienempää pitoisuutta?
Kun bakteeri etsii tietyn kemiallisen signaalin, se tunnistaa tämä kemikaali, koska se liikkuu pitkin polkua. Jos se etenee pitoisuusgradienttia ylöspäin, se alkaa havaita kemiallisia molekyylejä yhä useammin. Jos se liikkuu pitoisuusgradienttia alaspäin, se alkaa havaita kemiallisia molekyylejä yhä harvemmin. Tämä lopulta määrittää suuntaa ja voimaa bias sen satunnainen kävellä.,
Ei-tasapainon Järjestelmä
Koska kemiallinen diffuusio on net kuljetus-prosessin, järjestelmän, jolla se tapahtuu ei ole tasapainoa järjestelmä (eli se ei ole levossa vielä). Monet klassisen termodynamiikan tulokset eivät ole helposti sovellettavissa Ei-tasapainoisiin järjestelmiin. Kuitenkin joskus esiintyä ns. lähes tasaisesti, joissa diffuusio prosessi ei ole muutoksen aika, jossa klassisen tuloksia voidaan paikallisesti soveltaa. Kuten nimestä voi päätellä, tämä prosessi ei ole oikea tasapaino, koska järjestelmä kehittyy edelleen.,
Non-equilibrium nesteen järjestelmät voidaan onnistuneesti mallinnettu kanssa Landau-Lifshitz vaihteleva hydrodynamics. Tässä teoreettinen viitekehys, diffuusio johtuu vaihtelut, joiden mitat vaihtelevat molekyyli mittakaavassa makroskooppinen mittakaavassa.
Kemiallinen diffuusio kasvaa entropia järjestelmä, eli diffuusio on spontaani ja irreversiibeli prosessi., Hiukkaset voivat levittää diffuusion, mutta ei spontaanisti uudelleen, jotta itse (poissa muutoksia järjestelmään, olettaen, ettei luoda uusia kemiallisia sidoksia, ja poissa ulkoiset voimat hiukkanen).
Lue Myös: Integraalifunktio Laskin – Lyhyt Esittely